
ŌŚ·ÖĪö»Æѧ֊£¬NH3»ņĘäĖ®ČÜŅŗŹĒŅ»ÖÖ³£ÓĆµÄ³Įµķ¼Į£¬ÓĆÓŚĪļÖŹµÄ·ÖĄėŗĶĢį“攣ŅŃÖŖ£ŗNH3•H2OµÄµēĄė³£ŹżK=1.8”Į10-5£¬K  sp[Mg(OH)2]=1.8”Į10-11”£ĻņĢå»żĪŖ1.0 L”¢ÅضČĪŖ2.0”Į10-4 mol”¤L-1µÄMgCl2ČÜŅŗÖŠĶØČėNH3£¬Čō²»æ¼ĀĒČÜŅŗĢå»ż±ä»Æ£¬µ±·“Ó¦æŖŹ¼ÓŠ°×É«³Įµķ³öĻÖŹ±£¬ĶØČėNH3µÄĢå»ż£Ø±ź×¼×“æö£©ĪŖ£Ø £©
sp[Mg(OH)2]=1.8”Į10-11”£ĻņĢå»żĪŖ1.0 L”¢ÅضČĪŖ2.0”Į10-4 mol”¤L-1µÄMgCl2ČÜŅŗÖŠĶØČėNH3£¬Čō²»æ¼ĀĒČÜŅŗĢå»ż±ä»Æ£¬µ±·“Ó¦æŖŹ¼ÓŠ°×É«³Įµķ³öĻÖŹ±£¬ĶØČėNH3µÄĢå»ż£Ø±ź×¼×“æö£©ĪŖ£Ø £©
A£®112mL B£®224mL C£®118.72 mL D£®201.6 mL
 »īĮ¦ŹŌ¾ķĻµĮŠ“š°ø
»īĮ¦ŹŌ¾ķĻµĮŠ“š°ø æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø
æĪæĪÓÅÄÜĮ¦ÅąÓÅ100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģ½Ī÷Ź”øßČżÉĻѧʌµŚ¶ž“Ī¶Īæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĄė×Ó·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ( )
A£®ŌŚFe(OH)3½ŗĢåÖŠ¼ÓČėHIČÜŅŗ£ŗFe(OH)3 + 3H+ = Fe3+ + 3H2O
B£®±ź×¼×“æöĻĀ½«112mlĀČĘų ĶØČė6ml 1mol/LµÄµā»ÆŃĒĢśČÜŅŗÖŠ3Cl2 + 2Fe2
ĶØČė6ml 1mol/LµÄµā»ÆŃĒĢśČÜŅŗÖŠ3Cl2 + 2Fe2 + + 4I-£½6Cl- +
+ + 4I-£½6Cl- +  2Fe3+ + 2I2
2Fe3+ + 2I2
C£®Ļņ³ĪĒåŹÆ»ŅĖ®ÖŠ¼ÓČė×ćĮæNaHCO 3ČÜŅŗ£ŗ Ca2+ + OH- + HCO3- = CaCO3”ż+ H2O
3ČÜŅŗ£ŗ Ca2+ + OH- + HCO3- = CaCO3”ż+ H2O
D£®ÓĆH2O2ŗĶH2SO4µÄ»ģŗĻČÜŅŗŹ“æĢĶ£ŗCu+ H2O2+2H+=Cu2++2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗžÄĻŹ”ŅęŃōŹŠøßČżÉĻѧʌµŚ¶ž“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¾Ż”¶Ģģ¹¤æŖĪļ”·¼ĒŌŲ£¬ĪŅ¹ś¹Å“śŅŌĀÆøŹŹÆ(Ö÷ŅŖ³É·ÖŹĒZnCO3)Ą“Ņ±Į¶ŁĮĒ¦(¼“Šæ),ĘäŌĄķČēĶ¼2”£ŅŃÖŖŠæµÄČŪµć420”ę”¢·Šµć906”ę”£ŌņĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ( )

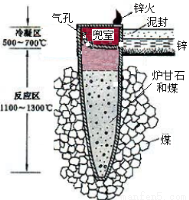
Ķ¼1 Ķ¼2
A£®”°Äą·ā”±µÄÄæµÄŹĒĪŖĮĖ·ĄÖ¹µĆµ½µÄŠæ±»Ńõ»Æ
B£®”°Šæ»š”±ŹĒŠæÕōĘųŗĶŅ»Ńõ»ÆĢ¼ŌŚæÕĘųµÄČ¼ÉÕ
C£®Ņ±Į¶Ź±Šæ±äĪŖÕōĘųŌŚ¶µŹŅĄäÄżĪŖ¹ĢĢå
D£®ÉżĮ¶ŁĮĒ¦¹ż³Ģ°üŗ¬·Ö½ā·“Ó¦ŗĶŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗžÄĻŹ”ŹµŃé°ąøßČżÉĻµŚŅ»“ĪÖŹ¼ģ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹¤ŅµÉĻ£¬æÉÓĆĮņĖįīę[Ce(SO4)2]ČÜŅŗĪüŹÕĪ²ĘųÖŠNO£¬Ęä»Æѧ·½³ĢŹ½ČēĻĀ£ŗ2NO£«3H2O£«4Ce(SO4)2£½2Ce2(SO4)3£«HNO3£«HNO2£«2H2SO4 ,ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®ŌŚøĆ·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć2
B£®ŌŚøĆ·“Ó¦ÖŠ£¬Ńõ»Æ²śĪļÓŠĮ½ÖÖ£¬»¹Ō²śĪļÓŠŅ»ÖÖ
C£®Čō²»æ¼ĀĒČÜŅŗĢå»ż±ä»Æ£¬ĪüŹÕĪ²Ęųŗó£¬ČÜŅŗµÄpH½«Ōö“ó
D£®ŌŚøĆ·“Ó¦ÖŠ£¬ĆæĻūŗÄ22.4LNO±Ų×ŖŅĘ2 molµē×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżÉĻѧʌ9ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
[Ń”ŠŽ3£ŗĪļÖŹ½į¹¹ÓėŠŌÖŹ]
øł¾ŻŌŖĖŲÖÜĘŚ±ķÖŠµŚĖÄÖÜĘŚŌŖĖŲµÄĻą¹ŲÖŖŹ¶£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©µŚĖÄÖÜĘŚŌŖĖŲµÄ»łĢ¬Ō×ӵĵē×ÓÅŲ¼ÖŠ4s¹ģµĄÉĻÖ»ÓŠ1øöµē×ÓµÄŌŖĖŲÓŠ____________ÖÖ£»Š“³öCu+µÄŗĖĶāµē×ÓÅŲ¼Ź½____________”£
£Ø2£©°“µē×ÓÅŲ¼£¬æɽ«ÖÜĘŚ±ķĄļµÄŌŖĖŲ»®·Ö³ÉĪåøöĒųÓņ£¬µŚĖÄÖÜĘŚŌŖĖŲÖŠŹōÓŚsĒųµÄŌŖĖŲÓŠ_________ÖÖ£¬ŹōÓŚdĒųµÄŌŖĖŲÓŠ____________ÖÖ”£
£Ø3£©CaO¾§°ūČēĻĀĶ¼ĖłŹ¾£¬CaO¾§ĢåÖŠCa2+µÄÅäĪ»ŹżĪŖ____________£»
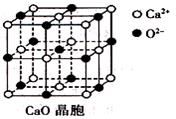
£Ø4£©ÓɵžµŖ»Æ¼Ų(KN3)ČČ·Ö½āæɵƓæN2£ŗ2KN3(s)=2K(l)+3N2(g)£¬ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ________(ĢīŃ”Ļī×ÖÄø£©”£
A£®NaN3ÓėKN3½į¹¹ĄąĖĘ£¬Ē°Õß¾§øńÄܽĻŠ” |
B£®¾§Ģå¼ŲµÄ¾§°ū½į¹¹ČēĶ¼ĖłŹ¾£ŗ |
C£®µŖµÄµŚŅ»µēĄėÄÜ“óÓŚŃõ |
D£®µŖĘų³£ĪĀĻĀŗÜĪČ¶Ø£¬ŹĒŅņĪŖµŖµÄµēøŗŠŌŠ” |
£Ø5£©¶žŃõ»ÆīŃ(TiO2)ŹĒ³£ÓƵĔ¢¾ßÓŠ½Ļøߓ߻ƻīŠŌŗĶĪČ¶ØŠŌµÄ¹ā“߻ƼĮ”£O2ŌŚĘä“ß»Æ×÷ÓĆĻĀ£¬æɽ«CN-Ńõ»Æ³ÉCNO-”£CN-µÄµē×ÓŹ½ĪŖ___________£¬CNO-µÄÖŠŠÄŌ×ÓµÄŌӻƷ½Ź½ĪŖ___________”£
£Ø6£©ŌŚCrCl3ČÜŅŗÖŠ£¬Ņ»¶ØĢõ¼žĻĀ“ęŌŚ×é³ÉĪŖ[CrCln(H2O)6£n]x£«(nŗĶx¾łĪŖÕżÕūŹż£©µÄÅäĄė×Ó£¬½«ĘäĶعżĒāĄė×Ó½»»»Ź÷Ö¬£ØR£H)£¬æÉ·¢ÉśĄė×Ó½»»»·“Ó¦£ŗ
[CrCln(H2O)6£n]x£«+xR-H”śRx[CrCln(H2O)6£n]+xH+”£
½«ŗ¬0.0015mol[CrCln(H2O)6£n]x£«µÄČÜŅŗ£¬ÓėR£HĶźČ«½»»»ŗó£¬ÖŠŗĶÉś³ÉµÄH£«ŠčÅضČĪŖ0.1200 mol/LNaOHČÜŅŗ25.00 mL£¬ŌņøĆÅäĄė×ӵĻÆѧŹ½ĪŖ_____________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżÉĻѧʌ9ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĄė×Ó·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ£Ø £©
A£®ŅŃÖŖµēĄė³£ŹżH2SO3 K1=1.3”Į10-2 K2=6.3”Į10-8£»H2CO3 K1=4.2”Į10-7 K2=5.6”Į10-11”£
H2SO3ČÜŅŗŗĶNaHCO3ČÜŅŗ·“Ó¦£ŗH2SO3+2HCO3-=SO32-+2CO2”ü+2H2O
B£®æŲÖĘpHĪŖ9~10£¬ÓĆNaClOČÜŅŗ½«ŗ¬NaCNµÄ·ĻĖ®ÖŠµÄCN-Ńõ»ÆĪŖĮ½ÖÖĪŽĪŪČ¾µÄĘųĢå£ŗ
2CN-+5ClO-+2H+=N2ӟ+2CO2ӟ+5Cl-+H2O
C£®ŅŃÖŖĮņĖįĒ¦ÄŃČÜÓŚĖ®£¬Ņ²ÄŃČÜÓŚĻõĖį£¬Č“æÉČÜÓŚ“×Ėįļ§ČÜŅŗÖŠ£¬ŠĪ³ÉĪŽÉ«ČÜŅŗ”£µ±Pb(CH3COO)2ČÜŅŗÖŠĶØČėH2SĘųĢåŹ±ÓŠŗŚÉ«³ĮµķÉś³É£ŗPb2++H2S=PbS”ż+2H+
D£®CuSO4ČÜŅŗÓė¹żĮæÅØ°±Ė®·“Ó¦£ŗCu2++4NH3”¤H2O=[Cu(NH3)4]2++4H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģŗž±±Ź”øßČżÉĻѧʌ9ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖA”¢B”¢D”¢E¾łĪŖ»Æѧ֊µÄ³£¼ūĪļÖŹ£¬ĖüĆĒÖ®¼äµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾(²æ·Ö²śĪļĀŌČ„)£¬ŌņĻĀĮŠÓŠ¹ŲĪļÖŹµÄĶʶĻ²»ÕżČ·µÄŹĒ£Ø £©

A£®ČōAŹĒĢś£¬ŌņEæÉÄÜĪŖĻ”ĻõĖį
B£®ČōAŹĒCuO£¬EŹĒĢ¼£¬ŌņBĪŖCO
C£®ČōAŹĒNaOHČÜŅŗ£¬EŹĒCO2£¬ŌņBĪŖNaHCO3
D£®ČōAŹĒAlCl3ČÜŅŗ£¬EæÉ ÄÜŹĒ°±Ė®
ÄÜŹĒ°±Ė®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğŗÓÄĻŹ”ø߶žÉĻµŚŅ»“Īæ¼ŹŌ»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŅŃÖŖ·“Ó¦£ŗ¢Ł101kPaŹ±£¬2C(s)£«O2(g)£½2CO(g) ”÷H£½£221kJ/mol
¢ŚĻ”ČÜŅŗÖŠ£¬H£«(aq)£«OH£(aq)£½H2O(1) ”÷H£½£57.3kJ/mol
ĻĀĮŠ½įĀŪÕżČ·µÄŹĒ
A£®Ģ¼µÄČ¼ÉÕČČŹĒ110.5kJ/mol
B£®¢ŁµÄ·“Ó¦ČČĪŖ221kJ/mol
C£®Ļ”ĮņĖįÓėĻ”NaOHČÜŅŗ·“Ó¦µÄÖŠŗĶČČĪŖ£57.3kJ /mol
/mol
D£®Ļ”ŃĪĖįÓėĻ”NaOHČÜŅŗ·“Ӧɜ³É1molĖ®£¬·Å³ö57.3kJČČĮæ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2017½ģÕć½Ź”ÉÜŠĖŹŠøßČżÉĻѧʌŹŹÓ¦ŠŌæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠŹōÓŚŃõ»Æ»¹Ō·“Ó¦µÄŹĒ£Ø £©
A£®2KI+Br2 =2KBr+I2
B£®CaCO3 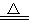 CaO+CO2”ü
CaO+CO2ӟ
C£®SO3+H2O = H2SO4
D£®MgCl2+2NaOH = Mg(OH)2”ż+NaCl
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com