
| A. | 除去溶液中Ag+加盐酸盐比硫酸盐好 | |
| B. | 加入H20,溶解平衡不移动 | |
| C. | 用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 | |
| D. | 反应2AgCl+Na2S═Ag2S+2NaCl 说明溶解度:AgCl>Ag2S |
分析 A.依据氯化银溶解度小于硫酸银分析判断;
B.加水沉淀溶解,平衡正向进行;
C.氯化钠溶液中氯离子抑制程度溶解平衡,平衡左移,减少沉淀损失;
D.依据沉淀转化的实质分析.
解答 解:A.氯化银溶解度小于硫酸银,除去溶液中Ag+加盐酸盐比硫酸盐好,故A正确;
B.加入H20,沉淀溶解平衡正向进行,故B错误;
C.用NaCl溶液代替蒸馏水洗涤AgCl,氯化钠溶液中氯离子抑制程度溶解平衡,平衡左移,可以减少沉淀损失,故C正确;
D.反应2AgCl+Na2S═Ag2S+2NaCl,反应向更难溶的方向进行,说明溶解度:AgCl>Ag2S,故D正确;
故选B.
点评 本题考查了沉淀溶解平衡的影响因素分析,溶度积随温度变化,沉淀转化的实质分析,题目难度中等.


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:解答题
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 0 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀H2SO4反应 | B. | Ba(OH)2•8H20与NH4CI的反应 | ||
| C. | 甲烷在02中的燃烧反应 | D. | 灼热的炭与C02反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,28g C2H4中含有的极性共价键数为6NA | |
| B. | 在氢氧化钡溶液中加入少量的硫酸氢钠溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| C. | 浓度均为0.1 mol•L-1的C6H5ONa溶液和CH3COONa溶液中:阴离子的总浓度前者小于后者 | |
| D. | 常温下,浓度分别为0.1 mol•L-1和0.01 mol•L-1的CH3COOH溶液中:CH3COO-离子浓度前者是后者的10倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知H2的标准燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为: H2(g)+1/2O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ | |
| C. | NH4HSO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | NaClO溶液与FeCl2溶液混合:Fe2++2ClO-+2H2O═Fe(OH)2↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
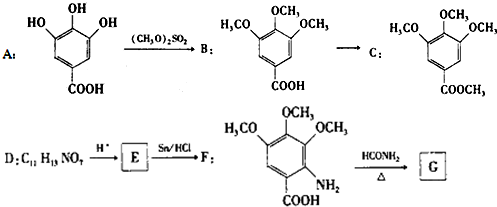
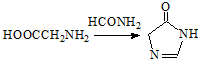
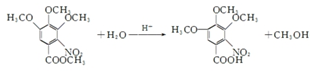 .
.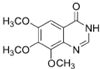 .
.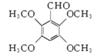 .
.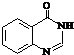 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.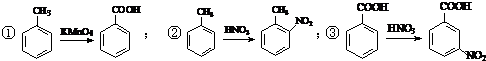 )
)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com