
|
将Cu放入0.1 mol·L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Cu2+与Fe3+的物质的量之比为 | |
A. |
3∶2 |
B. |
3∶5 |
C. |
4∶3 |
D. |
3∶4 |
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:阅读理解
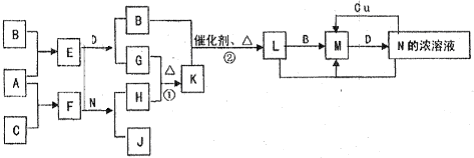


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||

t(min) 浓度(mol/L) |
0 | 1 | 2 | 3 | 4 | 5 | 6 |
| c(C) | 0.054 | 0.034 | 0.018 | 0.012 | 0.008 | 0.006 | 0.006 |
| c(O2) | 0.032 | 0.022 | 0.014 | 0.011 | 0.009 | 0.008 | 0.008 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
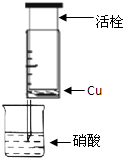 某研究性学习小组设计不同实验方案来研究硝酸的性质.
某研究性学习小组设计不同实验方案来研究硝酸的性质.| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。
A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 | m(Cu)/g | 硝酸(过量) | 溶液颜色 |
| A | 1 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| B | 0.5 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 | |
| C | 2 | 浓HNO3(4mL) | 溶液为绿色 |
| 1 | 稀HNO3(4mL) | 溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是 。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确, 三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因 。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理__________ ____________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个 。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省杭州地区七校高一下学期期中联考化学试卷(解析版) 题型:实验题
(13分)某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。

A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后 。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是 。
②一段时间后在针筒内观察到溶液颜色为蓝色,有 色气体产生。该反应的离子方程式为 。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是 。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
|
组 |
m(Cu)/g |
硝酸(过量) |
溶液颜色 |
|
A |
1 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
|
B |
0.5 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
|
C |
2 |
浓HNO3(4mL) |
溶液为绿色 |
|
1 |
稀HNO3(4mL) |
溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是 。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确, 三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因 。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理__________ ____________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com