
| m |
| M |
| n |
| V |
| m |
| M |
| 5.825g |
| 233g/mol |
| 0.025mol |
| 0.1L |
| 11.82g |
| 197g/mol |
| 0.17mol |
| 0.2L |


科目:高中化学 来源: 题型:
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(OH-)>c(HF) |
| D、c(HF)>c(F-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质的量 | CO2 | H2 | CH3OH(g) | H2O |
| 甲 | a mol | a mol | 0mol | 0mol |
| 乙 | 2a mol | a mol | 0mol | 0mol |
| 丙 | 0mol | 0mol | a mol | a mol |
| 丁 | a mol | 0mol | a mol | a mol |
| A、甲 | B、乙 | C、丙 | D、丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4和C2H4 |
| B、C2H2和C2H6 |
| C、C2H4和C3H4 |
| D、C4H8和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
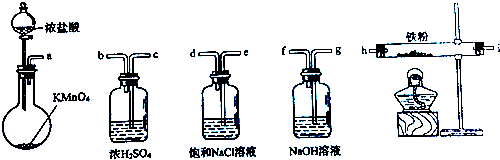
| A、a-b-c-d-e-e-f-g-h |
| B、a-e-d-c-b-h-i-g |
| C、a-d-e-c-b-h-i-g |
| D、a-c-b-d-e-h-i-f |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,N2将完全转化为NH3 |
| B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C、达到化学平衡时,正反应和逆反应的速率都为零 |
| D、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在密闭容器中加入等浓度的CO与H2O,T℃时发生如下反应:
在密闭容器中加入等浓度的CO与H2O,T℃时发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2在负极发生的电极反应是:2H2+4OH--4e-═4H2O |
| B、供电时的总反应为:2H2+O2═2H2O |
| C、O2正极的电极反应是:O2+2H2O+4e-═4OH- |
| D、燃料电池的能量转化率可达100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com