
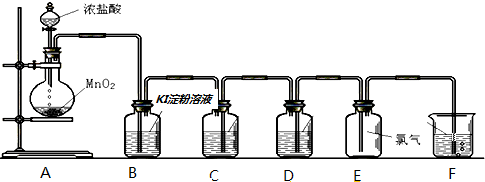
分析 实验室用浓盐酸与二氧化锰加热条件下反应生成氯气、氯化锰和水来制备氯气,氯气具有强的氧化性能够氧化碘离子生成单质碘,浓盐酸易挥发,所以制备的氯气中含有氯化氢和水,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性,所以用盛有饱和食盐水的C装置吸收氯气中的氯化氢,用盛有浓硫酸的D装置干燥氯气,氯气有毒不能直接排放到空气中,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可用氢氧化钠吸收过量的氯气.
解答 解:实验室用浓盐酸与二氧化锰加热条件下反应生成氯气、氯化锰和水来制备氯气,氯气具有强的氧化性能够氧化碘离子生成单质碘,浓盐酸易挥发,所以制备的氯气中含有氯化氢和水,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性,所以用盛有饱和食盐水的C装置吸收氯气中的氯化氢,用盛有浓硫酸的D装置干燥氯气,氯气有毒不能直接排放到空气中,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可用氢氧化钠吸收过量的氯气.
(1)浓盐酸与二氧化锰加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,生成1mol氯气转移2mol电子,则转移的电子的物质的量为0.4mol,生成氯气的物质的量为0.2mol,标况下体积为0.2mol×22.4L/mol=4.48L;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;4.48;
(2)氯气具有强的氧化性能够氧化碘离子生成单质碘,化学方程式:2KI+Cl2=2KCl+I2,淀粉遇到碘变蓝色;
故答案为:2KI+Cl2=2KCl+I2,溶液变蓝;
(3)浓盐酸易挥发,所以制备的氯气中含有氯化氢和水,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以用盛有饱和食盐水的C装置吸收氯气中的氯化氢,
故答案为:吸收氯气中的氯化氢;
(4)浓硫酸具有吸水性,能够干燥氯气;
故答案为:干燥氯气;
(5)氯气有毒不能直接排放到空气中,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可用氢氧化钠吸收过量的氯气;
故答案为:吸收过量的氯气,进行尾气处理.
点评 本题考查了氯气的制备、净化、收集及性质的检验,明确氯气制备原理和氯气性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的物质的量相等 | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液和稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 碳酸钙和醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | AlCl3溶液中加入过量稀氨水:Al3++4 NH3•H2O═AlO2-+4NH4++2 H2O | |
| D. | 用少量Ca(OH)2与NaHCO3反应:Ca2++2OH-+2HCO3-═CaCO3↓+H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 | 固体完全溶解得无色澄清溶液 |
| 步骤2:加入过量盐酸 | |
| 步骤3:静置后取上清液,加入BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误食重金属盐可立即喝鲜牛奶或鸡蛋清解毒 | |
| B. | 硅是人类将太阳能转换为电能的常用材料 | |
| C. | Al(OH)3可用来治疗胃酸过多,其原因是发生了氧化还原反应 | |
| D. | 高铁酸钾(K2FeO4)是新型高效多功能水处理剂,既能消毒杀菌又能净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加Zn片质量 | B. | 增加盐酸的体积 | ||
| C. | 滴加几滴CuSO4溶液 | D. | 升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com