
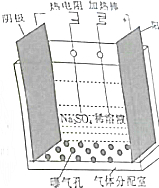
 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:分析 (1)BaO2与稀硫酸反应生成硫酸钡沉淀和H2O2,据此书写方程式,根据方程式计算每生成1molH2O2,消耗BaO2的物质的量;
(2)氧化还原反应中,元素化合价升高的反应物为还原剂,根据题干信息书写方程式,根据方程式中元素的化合价变化分析该反应的还原剂;
(3)过氧化氢是弱电解质属于二元弱酸分部电离,以第一步电离为主;根据Ka求出氢离子的浓度和pH;
(4)电解时,阴极上氧气得电子,生成过氧化氢,阳极电解水生成的氢气失去电子生成氢离子.
解答 解:(1)BaO2与稀硫酸发生复分解反应,生成硫酸钡沉淀和H2O2,反应方程式为:BaO2+H2SO4=BaSO4↓+H2O2,由方程式可知,每生成1molH2O2,消耗BaO21mol,
故答案为:1;
(2)H2O2、硼砂(Na2B4O7)及氢氧化钠可合成过硼酸钠(NaBO3•4H2O),所以该反应的方程式为:4H2O2+11H2O+Na2B4O7+2NaOH=4NaBO3•4H2O,该反应中:过氧化氢(O从-1→-2),H2O2为氧化剂,硼砂(Na2B4O7)(B从+3→+5),Na2B4O7为还原剂,
故答案为:Na2B4O7;
(3)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为:H2O2?H++HO2- HO2-?H++O22-以第一步电离为主,Ka1=4.0×10-12,则Ka1=$\frac{c({H}^{+})c(H{{O}_{2}}^{-})}{c({H}_{2}{O}_{2})}$=$\frac{c({H}^{+})}{1mol/L}$=4.0×10-12,所以c(H+)=2×10-6mol/L,即pH=6-lg2≈5.7,
故答案为:5.7;
(4)直接电解水并通入O2制取H2O2,阴极电极反应式为:O2+2e-+2H+=H2O2,阳极电解水生成的氢气失去电子H2-2e-=2H+,所以电解过程中阳极周围溶液的pH减小,
故答案为:O2+2e-+2H+=H2O2;减小.
点评 本题综合考查过氧化氢的有关知识,为高考常见题型和高频考点,涉及电解、氧化还原,方程式书写等,侧重于学生的分析能力的考查,本题注意把握化学基本理论知识,注意相关知识的积累,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 利用潮汐发电是将化学能转化为电能 | |
| B. | 蒸馏法淡化海水的过程中一定发生了化学变化 | |
| C. | 从海水中可以获得MgCl2,电解熔融MgCl2可制备Mg | |
| D. | 可以用分液的方法将海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
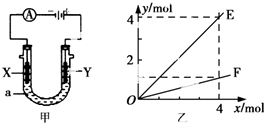
| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 molL-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入CaCl2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | SO2通入Na2S溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,H+、Mg2+、NO3-、Cl-可以大量共存 | |
| B. | 该溶液能使淀粉碘化钾试纸变蓝,反应的离子方程式为:Fe3++2I-═Fe2++I2 | |
| C. | 该溶液和足量Ba(OH)2溶液反应的离子方程式为:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | 该溶液与足量铜粉反应的离子方程式为:3Cu+2Fe3+═2Fe+3Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )
碱性硼化钒(VB2)-空气电池工作时反应为:4VB2+11O2═4B2O3+2V2O5.用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示.当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是( )| A. | 电解过程中,c电极表面先有红色物质析出,然后有气泡产生 | |
| B. | VB2电极发生的电极反应为:2VB2+11H2O-22e-═V2O5+2B2O3+22H+ | |
| C. | A装置中K+移向VB2电极 | |
| D. | b装置内收集的0.448L气体(标准状况)全部为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
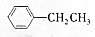 +Br2(g)$\stackrel{光照}{→}$
+Br2(g)$\stackrel{光照}{→}$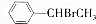 +HBr(一溴取代反应只发生在侧链的α碳原子上).
+HBr(一溴取代反应只发生在侧链的α碳原子上).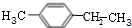 ,B1
,B1 ,B2
,B2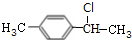 ,C1
,C1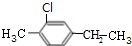 ,C2
,C2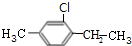 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
下列实验操作正确的是
A. 分液时,先将上层液体从上口倒出
B. 萃取时,振荡后,须打开活塞放气
C. 蒸馏时,先点燃酒精灯,后通冷凝水
D. 蒸发时,将溶剂蒸干一段时间后,熄灭酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 实验目的 | 反应物 | 反应前溶液的pH | 温度 |
| I | 对照实验 | O3+H2SO4+NaI | 5 | 25℃ |
| II | ① 探究FeCl2对反应速率的影响 | O3+H2SO4+NaI+FeCl2 | 5 | ? |
| III | 探究温度对速率的影响 | O3+H2SO4+NaI | ③ 5 | 5℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com