
| A. | 在氧化还原反应中,甲失电子比乙失电子多 | |
| B. | 甲在化合物中的化合价比乙在化合物中的高 | |
| C. | 甲能与稀盐酸反应生成氢气,而乙不能 | |
| D. | 甲与乙组成原电池时,甲为正极 |
分析 比较金属的活泼性,可根据金属元素的失电子能力,金属与酸反应的剧烈程度、置换反应,对应阳离子的氧化性强弱,组成原电池等角度解答.
解答 解:A.比较金属的活泼性应根据失去电子的难易程度,不能根据金属失去电子的多少判断,故A错误;
B.甲在化合物中的化合价比乙在化合物中的高,不能说明金属甲比金属乙活动性强,如Mg的化合价为+2价,Na为+1价,而Mg的金属活动性比Na弱,故B错误;
C.甲能跟稀盐酸反应放出氢气而乙不能,说明甲金属活动性在H之前,而乙在H之后,可说明甲比乙活泼,故C正确;
D.一般原电池中活泼性强的金属为负极,甲与乙组成原电池时,甲为正极,则活泼性乙比甲强,故D错误.
故选C.
点评 本题考查金属活动性的比较,题目难度不大,注意比较金属活动性的角度.


科目:高中化学 来源: 题型:选择题
| A. | X元素最高价氧化物对应的水化物一定是强酸 | |
| B. | X元素氢化物的化学式一定为H2X | |
| C. | X的单质一定是良好的半导体材料 | |
| D. | X元素的氧化物一定能与烧碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的燃烧热为1256 kJ•mol-1 | |
| B. | 若生成2 mol液态水,则△H=-2512 kJ•mol-1 | |
| C. | 若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ | |
| D. | 若转移10 mol电子,则消耗2.5 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
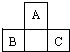 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
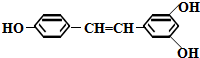 ,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )
,仅改变羟基(-OH)在苯环上的位置,且每个苯环上均含有羟基,可得到白藜芦醇的同分异构体甲,则甲可能的结构有( )| A. | 13种 | B. | 15种 | C. | 17种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 实验操作 | 主要现象 | 结论或解释 |
| 步骤1:取少量固体于试管中,加入足量 ①氯化铁溶液. | 固体减少且剩余, 淡黄色溶液变浅. | 固体中含有金属铁 |
| 步骤2:分离步骤1的剩余固体于另一试管中,加入足量 ②盐酸,将反应后溶液分成甲、乙两份. | 固体全部消失. | 反应的化学方程式 ③ Fe3O4+8HCl=FeCl2+2FeCl3+H2O. |
| 步骤3:在步骤2的甲溶液中加入几滴 ④高锰酸钾溶液. | 紫红色褪去. | 溶液中含有Fe2+. |
| 步骤4:在步骤2的乙溶液中加入几滴⑤KSCN溶液. | 溶液变成红色. | 溶液中含有Fe3+. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com