
【题目】A、B、X、Y、Z是原子序数依次增大的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数之比为2∶3;常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞溶液变红。请回答下列问题:
(1)Z 元素在元素周期表中的位置是______________ ,化合物A2X2的电子式为______________
(2)化合物A2X和A2Z中,沸点较高的是__________(填化学式),其主要原因是_____________
(3)A与X、A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为:_______
(4)将Z与X 形成的气态化合物ZX2通入Ba(NO3)2 溶液中,有白色沉淀和NO气体生成,发生反应的离子方程式为___________________
(5)两种均含A、X、Y、Z四种元素的化合物相互反应放出气体的反应离子方程式为:_________
【答案】 第三周期第 VIA 族 ![]() H2O 水分子间存在氢键 H2O2 + H2S = S↓+ 2H2O 3SO2 + 3Ba2+ + 2NO3- + 2H2O = 3BaSO4↓+ 2NO + 4H+ HSO3-+ H+ = SO2↑+ H2O
H2O 水分子间存在氢键 H2O2 + H2S = S↓+ 2H2O 3SO2 + 3Ba2+ + 2NO3- + 2H2O = 3BaSO4↓+ 2NO + 4H+ HSO3-+ H+ = SO2↑+ H2O
【解析】常见化合物Y2X2与水反应生成X的单质,说明化合物为Na2O2,所以Y为Na,X为O。A与Y同主族,X与Z同主族,说明A为H,Z为S。B与Z的最外层电子数之比为2∶3;说明B最外层有4个电子,B为C。
(1)Z为S,在周期表的第三周期第 VIA 族。化合物A2X2为过氧化氢,其电子式为![]() 。
。
(2)化合物A2X和A2Z中(即水和硫化氢),沸点较高的是H2O,原因是水分子之间会形成氢键,从而提高物质的沸点。
(3)A与X、A与Z均能形成18个电子的化合物,应该是过氧化氢和硫化氢,两者的反应一定是氧化还原反应,过氧化氢将硫化氢氧化为单质硫,所以方程式为:H2O2 + H2S = S↓+ 2H2O。
(4)将Z与X 形成的气态化合物ZX2(SO2)通入Ba(NO3)2 溶液中,有白色沉淀(硫酸钡)和NO气体生成,可以确定的反应物和生成物为:SO2 + Ba2+ + NO3- + →BaSO4↓+ NO,根据得失电子守恒得到:3SO2 + 3Ba2+ + 2NO3- → 3BaSO4↓+ 2NO,此时计算可得,方程式左边应该添加水,右边应该添加氢离子,所以发生反应的离子方程式为3SO2 + 3Ba2+ + 2NO3- + 2H2O = 3BaSO4↓+ 2NO + 4H+。
(5)两种均含A、X、Y、Z四种元素的化合物为NaHSO4和NaHSO3,两者反应的方程式为:NaHSO4+NaHSO3=Na2SO4 + SO2↑+H2O,所以离子方程式为:HSO3-+ H+ = SO2↑+ H2O。


科目:高中化学 来源: 题型:
【题目】下列有关环境污染的说法不正确的是( )
A.燃煤时加入适量生石灰,可减少废气中SO2的量
B.pH在5.6~7之间的降水通常称为酸雨
C.光化学烟雾的形成主要与NOx和碳氢化合物有关
D.含磷洗涤剂会导致水体污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述错误的是 ( )

A. 氢和R、W三种元素形成的阴离子有3种以上
B. RY2分子中每个原子的最外层均为8电子结构
C. R、Y、Z的最高价氧化物对应水化物的酸性依次增强
D. X、Z的氢化物的热稳定性和还原性,都依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物
A:CH2═CH2 B: ![]() C:CH3COOH
C:CH3COOH
(1)写出化合物A中官能团的名称;
(2)3种化合物中能使溴的四氯化碳溶液褪色的物质和溴的四氯化碳溶液反应的化学方程为:;具有特殊气味、常做有机溶剂的是(写名称).
(3)3种化合物中能与NaOH发生中和反应的是(写名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的△H>0,△S>0
B. 常温下,NH4Cl溶液加水稀释 增大
增大
C. 电解饱和食盐水产生了11.2LH2,则反应中转移的电子数为6.02×1023
D. 在NaCl和KI均为0.1 mo1·L-1的混合溶液中滴加AgNO3溶液,则先产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A.乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr→CH3CH2Br+H2O
B.甲烷和氯气在光照条件下的反应:2CH4+Cl2 ![]() 2CH3Cl+H2
2CH3Cl+H2
C.苯酚溶液中滴入NaOH溶液:H++OH﹣→H2O
D.苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O﹣→2C6H5OH+2CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、 ![]() 和
和 ![]()
D、35Cl和37Cl E、乙醇和乙二醇
(1)互为同位素的是;
(2)互为同系物的是;
(3)互为同素异形体的是;
(4)互为同分异构体的是;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍。
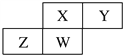
请回答下列问题:
(1)Z位于周期表中的位置______________。
(2)X、Y元素的氢化物中,较稳定性的是________(填化学式)。
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为_________。
(4)请写出X的最高价氧化物对应水化物的稀溶液与少量铁粉反应的离子反应方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com