
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| ||
|
| 0.08mol |
| 2L |
| 0.24mol |
| 2L |
| c(N2O4) |
| c(NO2) |
| 0.04mol/L |
| 0.12mol/L×0.12mol/L |
| 0.2mol |
| 2L |
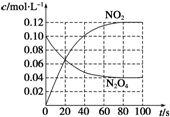 ,故答案为:0.1mol/L;
,故答案为:0.1mol/L; ;
;| 0.012mol |
| 0.2mol |


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源:不详 题型:单选题
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是| A.单位时间生成n mol的A2同时生成n mol的AB |
| B.容器内的总压强不随时间变化 |
| C.单位时间生成2n mol的AB同时生成n mol的B2 |
| D.单位时间生成n mol的A2同时生成n mol的B2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
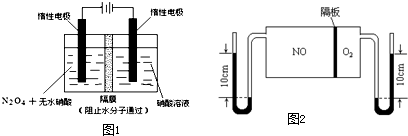
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
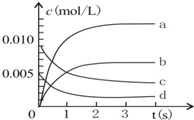
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石油和天然气的主要成分都是碳氢化合物 |
| B.乙醇、乙酸和乙酸乙酯可以用饱和碳酸钠溶液鉴别 |
| C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
| D.甘氨酸(NH2-CH2-COOH)既能与NaOH反应,又能与盐酸反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
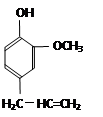
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com