
| A. | K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ | |
| B. | 增加B,平衡向右移动,B的平衡转化率增大 | |
| C. | 增大该体系的压强,平衡向左移动,化学平衡常数不变 | |
| D. | 此时B的平衡转化率是40% |
分析 2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)?4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则
3A(g)+2B(g)?4C(s)+2D(g)
开始 4 2 0 0
转化 1.2 0.8 1.6 0.8
平衡 2.8 1.2 1.6 0.8
A.C为固体,不能代入K的表达式中;
B.增加B,B的总量增大,转化率减小;
C.平衡常数只与温度有关;
D.转化率=$\frac{转化的量}{开始的量}$×100%.
解答 解:2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)?4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则
3A(g)+2B(g)?4C(s)+2D(g)
开始 4 2 0 0
转化 1.2 0.8 1.6 0.8
平衡 2.8 1.2 1.6 0.8
A.可逆反应3A(g)+2B(g)?4C(s)+2D(g)的平衡常数K=$\frac{{c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$,故A错误;
B.增加B的浓度增大,平衡向正反应移动,A的转化率增大,B的转化率降低,故B错误;
C.该反应正反应为气体体积减小的反应,增大压强平衡向正反应移动,即向右移动,化学平衡常数只受温度影响,增大压强平衡常数不变,故C错误;
D.达到平衡,参加反应的B的物质的量为1.6mol×$\frac{1}{2}$=0.8mol,故B的转化率为$\frac{0.8mol}{2mol}$×100%=40%,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握平衡常数的意义、浓度和压强对平衡的影响、转化率计算为解答的关键,侧重分析与应用能力的考查,注意反应中C为固体,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
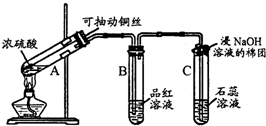
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
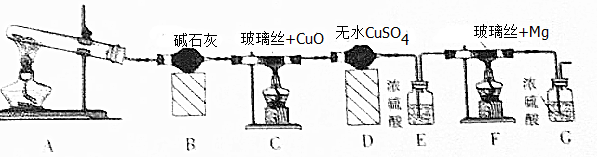
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A.Cl2 >Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
>Fe3+>I2 B.I2>Cl2>Fe3+ C.Fe3+>Cl2>I2 D.Cl2>I2>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
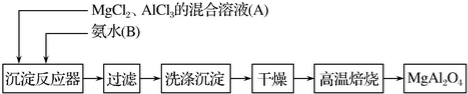
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正、逆反应速率都减小 | B. | 正、逆反应速率都增大 | ||
| C. | 逆反应速率增大,正反应速率减小 | D. | 逆反应速率减小,正反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数不变 | B. | n(O2)增大 | ||
| C. | SO2的体积分数增大 | D. | c(SO2)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 表示硫的燃烧热的热化学方程式S(s)+$\frac{3}{2}$O2(g)=SO3(g);△H=-315 kJ/mol | |
| B. | 表示中和热的热化学方程式NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ/mol | |
| C. | 表示H2燃烧热的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=-241.8 kJ/mol | |
| D. | 表示CO燃烧热的热化学方程式2CO(g)+O2(g)=2CO2(g);△H=-566 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com