
在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法正确的是
2Z(g),有关下列图像的说法正确的是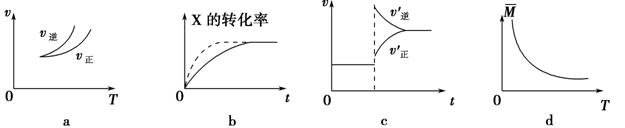
| A.依据图a可判断正反应为吸热反应 |
| B.在图b中,虚线可表示压强增大 |
| C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动 |
| D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0 |
C
解析试题分析:A.依据图a可知:当反应达到平衡后,由于升高温度,V逆>V正,平衡逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,因此可判断正反应为放热反应,错误;B.在图b中,平衡未移动,但是达到平衡所需要的时间缩短,由于该反应是气体体积减小的反应,所以虚线不可表示压强增大,只能表示是加入了催化剂,错误;C.若正反应的ΔH<0,升高温度,根据平衡移动原理,平衡逆向移动,故可以用图c可表示升高温度使平衡向逆反应方向移动,正确;D.由于升高温度,气体的平均相对分子质量增大,则根据平衡移动原理,升高温度,平衡向吸热反应方向移动,平衡逆向移动,可推知正反应的ΔH<0,错误。
考点:考查外界条件对化学平衡移动的影响的知识。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:计算题
多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下: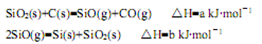
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H= kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是 。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
①X是 (填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃) K(950℃)(选填“>”、“<”、“=”)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为 。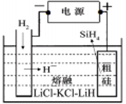
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知H+(aq)+OH-(aq) =H2O(l) ΔH=-57.3 kJ·mol-1,回答下列问题。
(1)仪器A的名称____ ___;碎泡沫塑料的作用是___________________。
(2)环形玻璃搅拌棒不能用环形铜质搅拌棒代替,其原因是______________ 。
(3)若通过实验测定中和热的ΔH的绝对值常常小于57.3 kJ/mol,其原因可能是_______
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定盐酸初始温度后,直接测定氢氧化钠溶液的温度
(4)将V1mL1.0mol·L-1 HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。由下图可知,氢氧化钠的浓度为 ;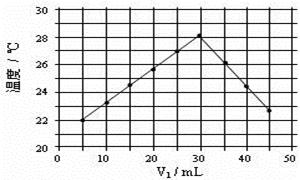
假设盐酸与氢氧化钠起始温度平均值为21.0℃,图中最高温度为28.0℃,并近似认为NaOH溶液和盐酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热ΔH = (取小数点后一位)。 (提示:Q=cmΔt)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在恒容密闭容器中,一定条件下进行如下反应:NO(g)+CO(g) 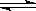
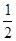 N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
| A.加催化剂同时升高温度 | B.加催化剂同时增大压强 |
| C.温度不变同时充入Ar | D.降低温度同时增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,可逆反应:X(g) + 3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),反应达到平衡时, X、Y、Z的浓度分别为0.1mol?L-1、0.3 mol?L-1、0.08 mol?L-1,则下列判断不正确的是 ( )
| A.c1∶c2="=" 1∶3 | B.平衡时,Y和Z生成速率之比为3∶2 |
| C.X、Y的转化率不相等 | D.c1的取值范围为0< c1< 0.14 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有可逆反应:X(g)+Y(g) 2Z(g)+W(s)
2Z(g)+W(s)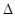 H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是
H<0,下图a曲线表示X的转化率随时间的变化关系。若改变起始条件使反应按b曲线进行,可采取的措施是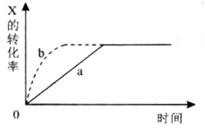
| A.降低温度 | B.增大Y的浓度 | C.加入催化剂 | D.增大容器的体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com