
分析 (1)根据n=$\frac{m}{M}$计算出氧气的物质的量,然后根据V=nVm计算出标况下氢气体积;
(2)根据c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$计算所得溶液浓度;溶液具有均一性,取出溶液浓度不变;根据m=nM=cVM计算含有溶质质量;根据稀释过程中溶质的物质的量不变计算出所得溶液浓度.
解答 解:(1)8g氧气的物质的量为:$\frac{8g}{32g/mol}$=0.25mol,标况下0.25mol氧气的体积为:22.4L/mol×0.25mol=5.6L,则氢气体积为5.6L,
故答案为:0.25mol;5.6L;
(2)20g氢氧化钠的物质的量为:$\frac{20g}{40g/mol}$=0.5mol,所得溶液浓度为:$\frac{0.5mol}{0.5L}$=1mol/L;从中取出1mL,溶液具有均一性,则取出溶液的物质的量浓度仍然为1mol/L;取出的1mL溶液中含有溶质的质量为:40g/mol×1mol/L×0.001L=0.04g;
若将这1mL溶液用水稀释到100mL,稀释过程中溶质的物质的量不变,则所得溶液中溶质的物质的量浓度为:$\frac{1mol/L×0.001L}{0.1L}$=0.01mol/L,
故答案为:1;1;0.04;0.01.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与其它物理量之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 等于0.1mol/L | B. | 大于0.1mol/L | C. | 小于0.1mol/L | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三者对应的氧化物均为碱性氧化物 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al | |
| D. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
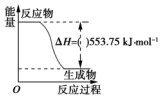 (1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:
(1)运动会中的火炬一般采用丙烷(C3H8)为燃料.丙烷热值较高,污染较小,是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
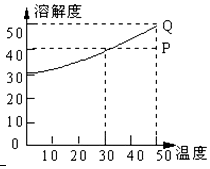 有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )
有一种盐的溶解度曲线如图,现有组成处于P点上的该溶液,下列说法错误的是(此盐不含结晶水)( )| A. | 50℃时,若该盐溶液含A克溶质,保持温度不变,加入A/4 g溶质,溶液必变成饱和溶液 | |
| B. | 50℃时,140g P点溶液最少需蒸发掉20g水才能形成饱和溶液 | |
| C. | 该溶液冷却至0℃时,析出溶质10 g | |
| D. | 在保持溶质及溶剂质量不变的情况下,使P点溶液达到饱和需降温20℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “血液透析”利用了胶体的性质 | |
| B. | 溶液是电中性的,胶体是带电的 | |
| C. | 一束光线分别通过溶液和胶体时,前者会出现明显的光带,后者则没有 | |
| D. | 浓NaOH溶液中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com