
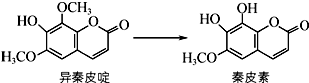
 异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )
异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )| A. | 异秦皮啶与秦皮素互为同系物 | |
| B. | 鉴别异秦皮啶与秦皮素可用溴水 | |
| C. | 1 mol秦皮素最多可与3 mol NaOH反应 | |
| D. | 每个异秦皮啶分子与氢气完全加成后的产物中含有5个手性碳原子 |
分析 A.结构相似,在分子组成上相差一个或n个-CH2原子团的有机物互称同系物;
B.异秦皮啶、秦皮素中都含有碳碳双键和酚羟基,都与溴水反应;
C.秦皮素中酚羟基和酯基水解生成的酚羟基、羧基能和NaOH反应;
D.连接四个不同的原子或原子团的碳原子为手性碳原子.
解答 解:A.结构相似,在分子组成上相差一个或n个-CH2原子团的有机物互称同系物,二者分子式相同、结构不同,属于同分异构体,故A错误;
B.异秦皮啶、秦皮素中都含有碳碳双键和酚羟基,都与溴水反应,二者属于溴水反应现象相同,无法用溴水鉴别,故B错误;
C.秦皮素中酚羟基和酯基水解生成的酚羟基、羧基能和NaOH反应,则1 mol秦皮素最多可与4 mol NaOH反应,故C错误;
D.连接四个不同的原子或原子团的碳原子为手性碳原子,每个异秦皮啶分子与氢气完全加成后的产物中除了最低端的C原子外都是手性碳原子,所以含有5个手性碳原子,故D正确;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确官能团及其性质关系是解本题关键,涉及基本概念、物质鉴别、物质性质等知识点,易错选项是C,注意秦皮素水解生成酚羟基和羧基.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molCO(g)完全燃烧生成CO2(g)放出热量283J | |
| B. | 1molCO(g)完全燃烧比1molC(s)完全燃烧放出的热量多 | |
| C. | 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2 (g)△H<-452kJ/mol | |
| D. | 当Na2O2(s)与CO2(g)反应生成Na2CO3(s)和O2 (g)放出452kJ热量时,转移的电子数为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(I-)=0.1mol•L-1的溶液中:Na+、Mg2+、ClO-、SO42- | |
| B. | 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl- | |
| C. | 与Al反应能放出大量H2的溶液中:Fe2+、Na+、NO3-、Cl- | |
| D. | 由水电离产生的c(OH-)=1×10-10 mol•L-1的溶液中:Ba2+、K+、NO3-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
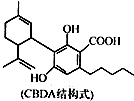
| A. | 1个CBDA分子中含有2个手性碳原子 | |
| B. | 1 mol CBDA 最多可与2molBr2反应 | |
| C. | 1 mol CBDA最多可与3 mol NaHCO3反应 | |
| D. | 1 mol CBDA最多可与2mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | |||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 | t1 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 | t2 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 | t3 |
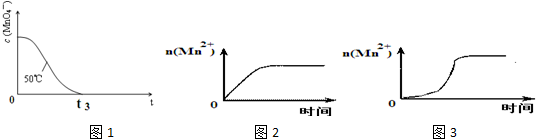
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 /℃ | 再向试管中加入少量固体 | 溶液颜色褪至无色所需时间/s | ||
| 浓度 /mol•L-1 | 体积 /mL | 浓度 /mol•L-1 | 体积 /mL | ||||
| ④ | 0.10 | 2.0 | 0.010 | 4.0 | 25 | MnSO4 | t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5 | B. | 2.7 | C. | 3.3 | D. | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com