
| ||
| ||
| ||
| ||


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:
| A、发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统 |
| B、含磷洗衣粉中的磷是植物生长的营养元素,洗衣水可排入河泊 |
| C、在入海口的钢铁闸门上装一定数量的锌块可防止闸门被腐蚀 |
| D、国家规定商家不得无偿提供塑料袋,是为了减少白色污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
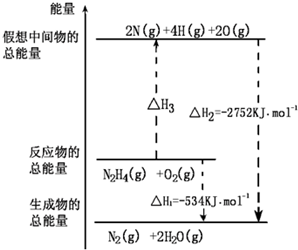 肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图,已知断裂1mol化学键所需的能量(kJ):N≡N为942、N-H为391、O=O为500,则断裂1molN-N键所需的能量(kJ)是( )| A、1327 | B、391 |
| C、516 | D、154 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
| A、溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B、方案一可能产生氢气,方案二可能剩余铜 |
| C、若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| D、实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol/L Na2S2O3和H2SO4各5 mL,加水5 mL,反应温度10℃ |
| B、0.1 mol/L Na2S2O3和H2SO4各5 mL,加水10 mL,反应温度10℃ |
| C、0.1 mol/L Na2S2O3和H2SO4各5 mL,加水5 mL,反应温度30℃ |
| D、0.2 mol/L Na2S2O3和H2SO4各5 mL,加水10 mL,反应温度30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含Fe3+、Cu2+、H+的溶液中加入锌粉:Cu2+、Fe3+、H+ |
| B、在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32- |
| C、在含I-、SO32-、Br-的溶液中不断通入氯气:I-、Br-、SO32- |
| D、在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:Fe3+、NH4+、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com