
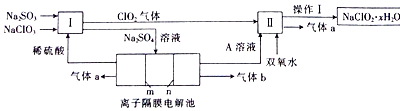
���� ��l�����ݹ�������ͼI�������ơ��������ƺ�ϡ���ᷴӦ���ɶ������Ⱥ������ƣ�SO32-+2ClO3-+H+=2ClO2+SO42-+H2O�����з�������������˫��ˮ�ڼ��������·�Ӧ����NaClO2��������2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O���������Ӹ�Ĥ�ĵ��۵��Na2SO4��Һ����֪����aΪO2���ü�Ϊ������OH-�ŵ磮
����������Ӿ���ǿ�����ԣ�����������Ӿ��л�ԭ�ԣ����߷�Ӧ������������ӺͶ����������壬���ݵ�ʧ�����غ�͵���غ���д��������ԭ��Ӧ�еõ����ӵķ�Ӧ��Ϊ��������ʧȥ���ӵķ�Ӧ��Ϊ��ԭ�����ݴ�������з�����Ӧ���������뻹ԭ�������ʵ���֮�ȣ�
��I�������ơ��������ƺ�ϡ���ᷴӦ���ɶ������Ⱥ������ƣ����з�������������˫��ˮ�ڼ��������·�Ӧ����NaClO2������������aΪO2���ü�Ϊ������������������������ӷŵ�����������
��2���ٵ��볣��Խ����̶�Խ����̼��ĵ��볣���Լ�������ĵ��볣���ȽϿ�֪��̼��Ķ������볣��С�ڴ�����ĵ��볣����̼��Ķ�������С�ڴ���������ԣ������������ˮ��Ӧ����������������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ���ݴ˷���ʹ��Һ��c��HClO����������ʣ�
�ڵ������Һ��Na2CO3 ��Һ��̼�������ˮ���Լ��ԣ�NaHCO3 ��Һ��̼���������ˮ���Լ��ԣ�NaClO��Һ�д��������ˮ���Լ��ԣ����ݵ��볣���ж�������ˮ��̶ȷ�����
��3���������Ⱦ��������ԣ������Ӿ��л�ԭ�ԣ����߷���������ԭ�����ɵⵥ�ʺ������ӣ����ݵ�ʧ�����غ���д���ӷ���ʽ��ClO2��Cl2һ����������ʱ��Ԫ�����ն���ΪCl-������ͬ������ϻ��ϼ۵ı仯���㣮
��� �⣺��1������������Ӿ���ǿ�����ԣ�����������Ӿ��л�ԭ�ԣ�����ͼʾ��֪������ClO2�����߷���������ԭ��Ӧ���ϼ۱仯Ϊ��S��+4��+6����ClO3-��+5��+4������С������Ϊ2�����ݵ�ʧ�����غ�͵���غ����ӷ���ʽΪ��SO32-+2ClO3-+H+=2ClO2+SO42-+H2O�����з�Ӧ�ķ���ʽΪH2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2����Ӧ��ClԪ�صĻ��ϼ۽��ͣ���ClO2Ϊ��������H2O2Ϊ��ԭ�����������뻹ԭ�������ʵ���֮��Ϊn��ClO2����n��H2O2��=2��1��
�ʴ�Ϊ��SO32-+2ClO3-+H+=2ClO2+SO42-+H2O��2��1��
�ڢ��з�������������˫��ˮ�ڼ��������·�Ӧ����NaClO2��������2ClO2+H2O2+2OH-=2ClO2-+O2+2H2O���������Ӹ�Ĥ�ĵ��۵��Na2SO4��Һ����֪����aΪO2���ü�Ϊ������OH-�ŵ�4OH--4e-=2H2O+O2������2H2O-4e-=4H++O2������
�ʴ�Ϊ������4OH--4e-=2H2O+O2������2H2O-4e-=4H++O2������
��2���ٳ�����̼��ĵ��볣��ΪK1=4.4��10-7��K2=4.7��10-11��������ĵ��볣��ΪK=3.0��10-8��̼��Ķ������볣��С�ڴ�����ĵ��볣����̼�����������С�ڴ���������ԣ���ˮ�У�Cl2+H2O?HCl+HClO��
a��̼���һ��������ڴ����ᣬNa2CO3�����������ᡢ�������ܷ�Ӧ����a����
b��̼�����������С�ڴ���������ԣ�NaHCO3 ���������ᷴӦ������������ᷴӦ����b��ȷ��
c��SO2�������ˮ��Ӧ��SO2+Cl2+2H2O�T2HCl+H2SO4������ʹc��HClO������c����
d������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����ӦΪCl2+2NaOH=NaCl+NaClO+H2O������ʹc��HClO������d����
�ʴ�Ϊ��b��
��̼��ĵ��볣��ΪK1=4.4��10-7��K2=4.7��10-11��������ĵ��볣��ΪK=3.0��10-8�����ԣ�H2CO3��HClO��HCO3-��CO32-������̼���Ƶ�ˮ��̶ȴ���̼�����ƣ�����NaClO����������ˮ��̶ȴ���̼�����ƣ�����pH��ͬʱ�������ʵ���Ũ���ɴ�С��˳����c��NaHCO3����C��NaClO����c��Na2CO3����
�ʴ�Ϊ��c��NaHCO3����C��NaClO����c��Na2CO3����
��3���������Ⱦ��������ԣ������Ӿ��л�ԭ�ԣ����߷���������ԭ�����ӷ���ʽΪ��2ClO2+10I-+8H+=4H2O+5I2+2Cl-��ClO2��Cl2һ����������ʱ��Ԫ�����ն���ΪCl-��2.24aLC12�����������ʵ���Ϊ0.1amol��ת��0.2amol���ӣ�����ͬƷ�ʵ�����ˮ���ﵽ��ͬ�Ĵ���Ч��ʱ����ʧ������ȣ����Ķ�������1mol��Ԫ�ػ��ϼ���+4�۱�Ϊ-1�ۣ�ת��5mol���ӣ�ת��0.2amol���ӣ���ClO2������$\frac{2}{5}$��0.1a��67.5g/mol=2.7a��
�ʴ�Ϊ��2ClO2+10I-+8H+=4H2O+5I2+2Cl-��2.7a��
���� ���⿼��������ԭ����⡢������ʵ��롢����ˮ���֪ʶ����Ŀ�Ѷ��еȣ�����ע��������ʵ����ʣ��������غ�ĽǶ��Լ�������ԭ��Ӧ���ص��ж�������Ϊ������Ĺؼ���Ҳ���״��㣮


 ����С����ͬ������ϵ�д�
����С����ͬ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
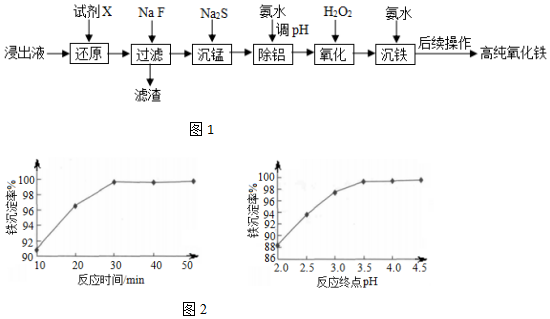
| �������� | Fe3+ | Fe2+ | Al3+ |
| ��ʼ������pH | 1.1 | 5.8 | 3.0 |
| ������ȫ��pH | 3.2 | 8.8 | 5.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��17��Ϊ±��Ԫ�� | |
| B�� | ��9��Ԫ����û�зǽ���Ԫ�� | |
| C�� | ֻ�е�2��Ԫ��ԭ�ӵ��������2������ | |
| D�� | ������18��Ԫ���У���3��Ԫ��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Fe��OH��3������ɫ�������ܲ������������ | |
| B�� | ��ˮ�Ȼ��ƿ�����ʳƷ����� | |
| C�� | ������һ�ַ�ɢϵ����ɢ���ǿ�����������̿���ַ�������ԭ��������ԭ�� | |
| D�� | �ú��轺�����۵���С����ʳƷһ���ܷ��װ���ù���û�з�����ѧ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ࡢ��֬�������ʶ�����Ȼ�߷��ӻ����һ�������¶���ˮ�� | |
| B�� | �ױ���C7H8�����ͣ�C3H8O3��������������һ��ʱ����$\frac{n��C{{\;}_{7}H}_{8}��}{n��{C}_{3}{H}_{8}{O}_{3}��}$��ֵ������ȫȼ�պ�����������ˮ���������� | |
| C�� | ����ʽΪC5H10O2���л���������NaOH��Һ��Ӧ����13�� | |
| D�� | ij���Ľṹ��ʽ�ɱ�ʾΪ  ��̼ԭ������12������֪�������������ֻ�ѧ������ͬ����ԭ�ӣ�����Ŀ֮��Ϊ3��2�������һ���DZ���ͬϵ�� ��̼ԭ������12������֪�������������ֻ�ѧ������ͬ����ԭ�ӣ�����Ŀ֮��Ϊ3��2�������һ���DZ���ͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ʵ��������ͼװ������ȡNH3 | B�� | 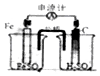 ʵ����ͼ̼��������ɫ���ݲ��� | ||
| C�� | 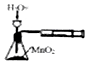 ʵ����ͼ�����ⶨH2O2�ķֽ����� | D�� |  ʵ����ͼ�����Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ά����Ҫ�ɷ���SiO2��̫���ܵ�ص���Ҫ�ɷ��ǵ��ʹ� | |
| B�� | īˮ��һ�ֽ��壬��ͬīˮ����ʱ����ʹ������ˮ�������߶��� | |
| C�� | ʳƷ��װ���ڳ��ù轺����ʯ�Һͻ�ԭ���ۣ���������ͬ | |
| D�� | ����������ʢװŨ�����ԭ��������淢���ۻ���Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȶ��ԣ�HF��NH3��SiH4�������� | |
| B�� | ԭ�Ӱ뾶��C��Al��K�������� | |
| C�� | ����ԣ�NaOH��Al��OH��3��Mg��OH��2���Լ��� | |
| D�� | �ǽ����ԣ�Cl��S��P������ǿ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com