
| A. | CH4、C2H4、C3H4 | B. | C2H4、C3H8、C2H6 | C. | C2H2、C2H4、C3H6 | D. | C2H2、C2H6、C3H8 |
分析 设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),根据体积变化,利用差量法计算,然后根据平均值法确定成份.
解答 解:设混合烃的平均组成为CxHy,
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O(l),△V
1 1+$\frac{y}{4}$
a 2a
则:(1+$\frac{y}{4}$):1=a:2a,
解得:y=4,
即混合气体分子中平均含有4个H原子,B中各种烃中H原子数都大于4,混合物的平均H原子数不可能为4,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,明确平均值法在化学试剂中的应用为解答关键,注意掌握平均值法的含义及应用方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:
某化学兴趣小组为探究SO2的化学性质,设计了如图所示的装置进行实验.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 10℃ | |
| B. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 10℃ | |
| C. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 5mL,反应温度 30℃ | |
| D. | 0.1mol/LNa2S2O3 和 H2SO4 各 5mL,加水 10mL,反应温度 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大,A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,C与B同主族,D元素的价电子数是其余电子数的一半,E与D同族,F与A同主族,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
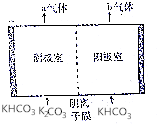 为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )
为实现CO2减排,目前较成熟的方法是用碳酸钾溶液为吸收剂捕集工业烟气中的CO2.利用电解法可实现吸收后的溶液(称为富液)的再生.将富液通人阴极室,将KHCO3溶液加入阳极室进行电解,其原理如图所示.下列有关描述不正确的是( )| A. | 阴极室产生的a气体是H2 | B. | 阳极室产生的b气体是CO2 | ||
| C. | 阴离子从阴极室向阳极室迁移 | D. | 再生液(K2CO3)在阴极室产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,7.8g该化合物与足量的CO2反应,转移电子数目为6.02×1022,固体增重为2.8g.
,7.8g该化合物与足量的CO2反应,转移电子数目为6.02×1022,固体增重为2.8g.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com