
【题目】向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为
A.7.84L B.6.72L C.4.48L D.无法计算
【答案】A
【解析】
试题分析:向18.4g铁和铜组成的合金中加入过量的硝酸溶液,反应生成了铁离子和铜离子,加入足量氢氧化钠溶液生成的沉淀为Fe(OH)3、Cu(OH)2,则氢氧化铁和氢氧化铁中含有的氢氧根离子的质量为:30.3g-18.4g=11.9g,氢氧根离子的物质的量为:n(OH-)=![]() =0.7mol;Cl2与铜、铁反应产物为:FeCl3、CuCl2,根据化合物总电荷为0可知,FeCl3、CuCl2中n(Cl-)=Fe(OH)3、Cu(OH)2中n(OH-),即n(Cl-)=0.7mol,根据质量守恒,消耗Cl2的物质的量为:n(Cl2)=
=0.7mol;Cl2与铜、铁反应产物为:FeCl3、CuCl2,根据化合物总电荷为0可知,FeCl3、CuCl2中n(Cl-)=Fe(OH)3、Cu(OH)2中n(OH-),即n(Cl-)=0.7mol,根据质量守恒,消耗Cl2的物质的量为:n(Cl2)=![]() n(Cl-)=0.35mol,标况下0.35mol氯气的体积为:22.4L/mol×0.35mol=7.84L,故选A。
n(Cl-)=0.35mol,标况下0.35mol氯气的体积为:22.4L/mol×0.35mol=7.84L,故选A。


科目:高中化学 来源: 题型:
【题目】(10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:

(1)T的原子结构示意图为 。
(2)元素的非金属性(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol![]() NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取l0mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少升?(保留两位有效数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,浓度均为0.2molL﹣1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A. ③①④②⑤ B. ①③⑤④② C. ③②①⑤④ D. ⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是
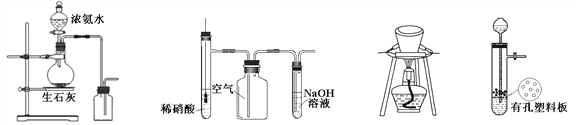
图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组用如下装置图验证NO2的氧化性和NO的还原性。请回答下列问题:

(1)写出甲中反应的离子方程式:______________;
(2)说明NO2具有氧化性的现象是_________________;
(3)说明NO具有还原性的操作和现象是______________;
(4)小组一成员对实验设计提出了质疑,他认为乙中的现象不足以证明NO2的氧化性,他的理由除了硝酸具有挥发性外,还有可能是_____________________________________;经小组讨论,他们设计了以下方案,其中合理的是__________
A.NO2与HCl气体混合 B.NO2与H2S气体混合 C.NO2通入Na2S溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.金属和非金属化合时一定形成离子键
D.含有共价键的化合物都是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com