
| 读数次数 | 质量/g | |
锥形瓶十水十试样 | 第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |
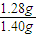 ×100%=91.4%,
×100%=91.4%,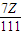 ,所以称量的氯化钙损耗越多,计算得到的碳化钙的质量越大,所占质量分数越大,在转移溶液时,如溶液转移不完全,损耗氯化钙,Z减少,Y增大,CaC2质量分数增大,所以测量结果偏高;
,所以称量的氯化钙损耗越多,计算得到的碳化钙的质量越大,所占质量分数越大,在转移溶液时,如溶液转移不完全,损耗氯化钙,Z减少,Y增大,CaC2质量分数增大,所以测量结果偏高;

科目:高中化学 来源: 题型:阅读理解
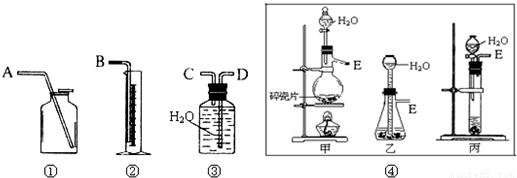
 现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:
现有含CaO杂质的CaC2试样.某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度.请填写下列空白:| 读数次数 | 质量/g | |
| 锥形瓶+水+试样 | 第1次 | 196.30 |
| 第2次 | 196.15 | |
| 第3次 | 196.05 | |
| 第4次 | 196.00 | |
| 第5次 | 196.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 读数次数 | 质量/g | |
锥形瓶十水十试样 |
第1次 | 196.4 |
| 第2次 | 196.2 | |
| 第3次 | 196.1 | |
| 第4次 | 196.0 | |
| 第5次 | 196.0 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com