
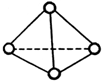
 科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )
科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图),与白磷分子相似.已知断裂1molN-N键吸收192kJ热量,断裂1molN≡N键吸收946kJ热量,则( )| A. | 1molN4气体转化为N2时要吸收206kJ能量 | |
| B. | N4是一种新型化合物 | |
| C. | 1molN4气体转化为N2时要放出740kJ能量 | |
| D. | N4是N2的同位素 |
分析 只有N元素组成,是一种单质,N4与N2互为同素异形体,根据N4=2N2,结合反应热等于反应物总键能减去生成物总键能计算反应热.
解答 解:A、则1molN4气体转化为N2的吸收或放出的热量为:6×191kJ-2×946kJ=-740kJ,该反应放热,故A错误;
B、N4由N组成,是一种单质,而化合物是由不同元素组成的纯净物,故B错误;
C、在N4=2N2反应中,根据反应热等于反应物总键能减去生成物总键能,则1molN4气体转化为N2的吸收或放出的热量为:6×191kJ-2×946kJ=-740kJ,则说明该反应放热,所以1molN4气体转化为N2时要放出740kJ能量,故C正确;
D、N4与N2都是由N元素形成的不同单质,互为同素异形体,故D错误.
故选C.
点评 本题考查反应热的计算以及有关概念的理解,题目难度不大,注意反应热与键能的计算关系,注重基础知识的积累.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | ① | ② | ③ | 实验结论 | 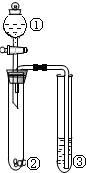 |
| A | 稀盐酸 | 石灰石 | 稀的碳酸钠溶液 | 溶解度:碳酸钠>碳酸氢钠 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸有脱水性、强氧化性 | |
| C | 浓硫酸 | Na2SO3 | 品红溶液 | 浓硫酸具有强氧化性 | |
| D | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 酸性:盐酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12 g | B. | 2.24 g | C. | 3.36 g | D. | 6.40 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电子式: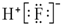 | |
| B. | H、D、T是氢元素的三种不同核素,互称同位素 | |
| C. | K+离子的结构示意图: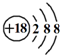 | |
| D. | 溴化钠的电子式: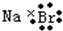 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 请回答:
请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 加入物质 | 现象 | 解释或离子方程式 |
| A | AgNO3溶液 | 有白色沉淀生成 | Cl-+Ag+═AgCl↓ |
| B | 石蕊试液 | 显红色 | 氯水中有盐酸、次氯酸 |
| C | CaCO3 | 有气体放出 | CO32-+2H+═H2O+CO2↑ |
| D | FeCl2和KSCN溶液 | 有红色沉淀生成 | 2Fe2++Cl2═2Fe3++2Cl- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com