
| A. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| C. | N2(g)+3H2(g)═2NH3(g)△H<0,升高温度,反应速率v(H2 )和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
分析 A.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护;
B.△H-T△S<0的反应能够自发进行;
C.升高温度化学平衡向吸热方向移动;
D.水的电离是吸热过程.
解答 解:A.Cu、Fe和电解质溶液构成原电池,Fe易失电子作负极、Cu作正极,所以Fe加速被腐蚀,故A正确;
B.该反应的△S>0,室温下不能自发进行,说明△H-T△S>0,所以该反应的△H>0,故B错误;
C.N2(g)+3H2(g)═2NH3(g)△H<0,升高温度化学平衡向吸热方向移动,即向逆方向移动,则H2的平衡转化率减小,反应速率v(H2 )增大,故C错误;
D.水的电离是吸热过程,升高温度水的电离程度增大,水的离子积常数Kw增大,故D错误.
故选A.
点评 本题考查了原电池原理的应用、反应自发进行的条件、化学平衡移动、水的电离等,题目难度不大,注意对基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡正向移动,溶液中c(H+)增大 | |
| B. | 加水,平衡正向移动,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 通入少量HCl,平衡逆向移动,溶液中c(H+)减少 | |
| D. | 加入少量CH3COONa固体,平衡逆向移动,溶液导电能力减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
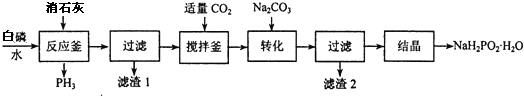
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L的 Fe2(SO4)3溶液中含有2NA个Fe3+(不考虑水解) | |
| B. | 1mol的 Fe2(SO4)3和S2-反应可转移2NA个电子 | |
| C. | 在该溶液中,K+、NH4+、I-、SO42-可以大量共存 | |
| D. | 与Cu反应的离子方程式为:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z | B. | Y>X>Z | C. | X>Z>Y | D. | Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.
;与甲分子具有相同电子数且含元素种类相同的离子有(填化学式)OH-、H3O+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com