
【题目】原电池是化学电源的雏形。若保持如图所示原电池的电池反应不变,下列说法正确的是
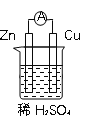
A. Zn可以换成Fe
B. Cu可以换成石墨
C. 稀H2SO4可以换成蔗糖溶液
D. 稀H2SO4可以换成CuSO4溶液
【答案】B
【解析】
在锌-铜(稀硫酸)原电池中,负极为锌,电极反应式为Zn-2e-=Zn2+,正极为铜,电极反应式为2H++2e-=H2↑,电池反应为Zn+2H+= Zn2++H2↑。据此分析解答。
A.若将Zn换成Fe,电池反应变成Fe+2H+=Fe2++H2↑,电池反应发生变化,故A错误;
B.若将Cu换成石墨,锌仍为负极,石墨为正极,电池反应为Zn+2H+= Zn2++H2↑,电池反应不变,故B正确;
C.若将稀H2SO4换成蔗糖溶液,蔗糖为非电解质,不能构成原电池,故C错误;
D.若将稀H2SO4换成CuSO4溶液,电池反应变成Zn+Cu2+=Zn2++ Cu,电池反应发生变化,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广阔的开发和应用前景,可用![]() 等作为催化剂,采用如下反应来合成甲醇:
等作为催化剂,采用如下反应来合成甲醇:![]()
(1)下表是有关化学键的键能数据,计算表中的a=__________。
化学键 |
|
|
|
|
|
键能 | 436 | 462.8 | a | 1075 | 351 |
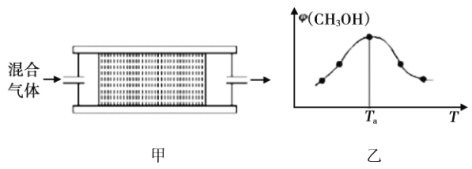
(2)将![]() 的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中
的混合气体,匀速通过装有催化剂的反应器反应(如图甲),反应器温度变化与从反应器排出气体中![]() 的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
的体积分数φ关系如图乙,φ(CH3OH)变化的原因是__________。
(3)某学习小组模拟工业合成甲醇的反应,在![]() 的恒容密闭容器内充入
的恒容密闭容器内充入![]() 和
和![]() ,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
,加入合适催化剂后在某温度下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
从反应开始到![]() 时,
时,![]() 的平均反应速率为______,该温度下的平衡常数
的平均反应速率为______,该温度下的平衡常数![]() 为______。
为______。
(4)另将![]() 和
和![]() 加入密闭容器中,在一定条件下发生上述反应。平衡时
加入密闭容器中,在一定条件下发生上述反应。平衡时![]() 的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
的体积分数(%)与温度和压强的关系如图所示(虚线框表示没有测定该条件下的数据)。
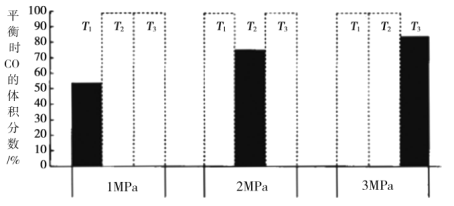
![]() 由大到小的关系是__________,判断理由是__________。
由大到小的关系是__________,判断理由是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是______(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
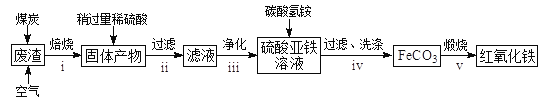
回答下列问题:
①在步骤i中产生的有毒气体可能有__________________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上使Al3+恰好沉淀完全即溶液中c(Al3+)=1×10-5mol/L,则溶液的pH为____________。
③步骤iv中,生成FeCO3的离子方程式是_________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入适量氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。这一过程的总反应的离子方程式______。
(4)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为碘晶体晶胞结构。有关说法中正确的是( )
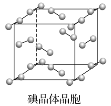
A. 碘晶体为无限延伸的空间结构,是原子晶体
B. 用切割法可知平均每个晶胞中有4个碘原子
C. 碘晶体中的碘原子间存在非极性键和范德华力
D. 碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式中,不正确的是( )
A.向FeCl2溶液中通入氯气,溶液变为黄色:2Fe2++ Cl2= 2Fe3++ 2Cl-
B.向铜粉中滴加稀硝酸,产生气体:Cu + 4H++ 2NO![]() =Cu2++ 2NO2↑+ 2H2O
=Cu2++ 2NO2↑+ 2H2O
C.向CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀:Cu2++ 2OH-=Cu(OH)2↓
D.自来水中通入Cl2可以杀菌消毒:Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是

A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH大小有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
(实验过程)

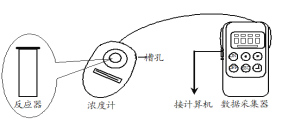
用图所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
(实验数据)
实验编号 | H2O2溶液 | Fe2+溶液 | 蒸馏水 | pH | 温度 | ||
c/(10-3mol·L-1) | V/mL | c/(10-3mol·L-1) | V/mL | V/mL | T/K | ||
① | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 298 |
② | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 3 | 313 |
③ | 6.0 | 3.5 | 0.30 | 3.5 | x | 3 | 298 |
④ | 6.0 | 1.5 | 0.30 | 4.5 | 9 | 3 | 298 |
⑤ | 6.0 | 1.5 | 0.30 | 3.5 | 10 | 10 | 298 |
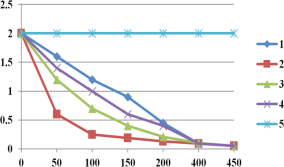
图2实验测得p-CP的浓度随时间的变化
(分析与解释)
(1)实验③中,x=________。
(2)实验①、⑤的目的是________。
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高是反而导致降解反应速率减少,从Fenton法所用试剂H2O2性质的角度分析原因_____(请用化学用语解答)。
(4)通过实验⑤可以得出结论是是pH等于10时,降解反应趋于停止,推测可能的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于柠檬酸(如图)的性质推测的叙述错误的是
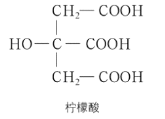
A.柠檬酸可与 NaHCO3 溶液反应生成 CO2
B.柠檬酸分子中具有羟基官能团,因此可与NaOH 溶液反应
C.家里可以用柠檬酸除水垢
D.柠檬酸分子中的两种官能团都能跟金属钠反应生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是

A. 分子式为 C6H6O6
B. 乌头酸既能发生水解反应,也能使酸性高锰酸钾溶液褪色
C. 乌头酸分子中所有碳原子可能共平面
D. 含 1 mol 乌头酸的溶液最多可消耗 3 mol NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com