
| A. | SiO32- K+ Fe3+ Cl- | B. | NO3- K+ Mg2+ SO42- | ||
| C. | ClO- Na+ HCO3- SCN- | D. | SO42- Mg2+ Cl- H+ |
分析 加入铝粉能产生氢气,为非氧化性酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应、相互促进水解等,则离子大量共存,以此来解答.
解答 解:加入铝粉能产生氢气,为非氧化性酸或强碱溶液,
A.酸性溶液中不能大量存在SiO32-,碱性溶液中不能大量存在 Fe3+,且SiO32-、Fe3+相互促进水解,不能共存,故A不选;
B.酸溶液中Al、NO3-发生氧化还原反应不生成氢气,碱性溶液中不能大量存在Mg2+,故B不选;
C.酸溶液中不能大量存在ClO-、HCO3-,碱溶液中不能大量存在 HCO3-,故C不选;
D.酸溶液中该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 洗净的检验是检验最后一次洗涤液中是否含有形成沉淀的该溶液中的离子 | |
| B. | 洗涤的试剂一般可选用蒸馏水、冰水、乙醇、该物质的饱和溶液 | |
| C. | 洗涤的目的一般是除去沉淀或晶体表面可溶性的杂质,提高纯度 | |
| D. | 洗涤的操作是向过滤器里加洗涤剂,一般洗涤剂尽量多加,然后让洗涤剂自然流下 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
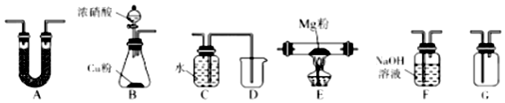
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 醋酸浓度(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
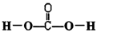 .
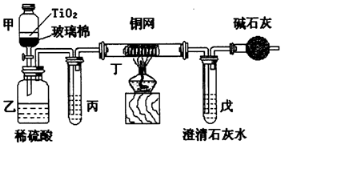
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
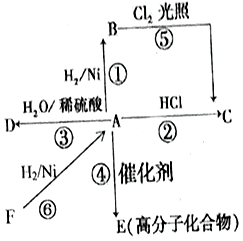 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消除散落在地上的汞珠的方法是撒上硫粉 | |
| B. | 铜丝擦亮后伸入到硫蒸气产物是CuS | |
| C. | 可以用CS2浸泡的方法除去附在玻璃器皿上的硫 | |
| D. | 可以用加热浓NaOH溶液除去附在试管内壁上的硫 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com