
�����г������ؽ�����Ⱦ���У�����Ǧ���̡������ӡ�������ҵ��ˮ�к��е�Cr2O72����CrO42�������õķ��������֡�
����1����ԭ������
�÷��Ĺ�������Ϊ ��
��
���еڢٲ�����ƽ��2CrO42��(��ɫ)��2H�� Cr2O72��(��ɫ)��H2O��
Cr2O72��(��ɫ)��H2O��
(1)д���ڢٲ���Ӧ��ƽ�ⳣ������ʽ_______________��
(2)���ڵڢٲ���Ӧ������˵����ȷ����________��
A��ͨ���ⶨ��Һ��pH�����жϷ�Ӧ�Ƿ��Ѵ�ƽ��״̬
B���÷�ӦΪ������ԭ��Ӧ
C��ǿ���Ի�������Һ����ɫΪ��ɫ
(3)�ڢڲ��У���ԭ0.1 mol Cr2O72������Ҫ________mol��FeSO4��7H2O��
(4)�ڢ۲�������Cr(OH)3�⣬���������ɵij���Ϊ________������Һ�д������³����ܽ�ƽ�⣺Cr(OH)3(s) Cr3��(aq)��3OH��(aq)�������£�Cr(OH)3���ܶȻ�Ksp��10��32����c(Cr3��)����10��5 mol��L��1ʱ����Ϊc(Cr3��)�Ѿ���ȫ�������ֽ��ڢ۲���Һ��pH����4����ͨ������˵��Cr3���Ƿ������ȫ(��д���������)��__________��
Cr3��(aq)��3OH��(aq)�������£�Cr(OH)3���ܶȻ�Ksp��10��32����c(Cr3��)����10��5 mol��L��1ʱ����Ϊc(Cr3��)�Ѿ���ȫ�������ֽ��ڢ۲���Һ��pH����4����ͨ������˵��Cr3���Ƿ������ȫ(��д���������)��__________��
����2����ⷨ
(5)ʵ����������ͼװ��ģ���ⷨ������Cr2O72���ķ�ˮ�����ʱ������ӦʽΪ________��������ӦʽΪ________���õ��Ľ������������������ɳ�����ȫ����ˮ�ĵ���ƽ��ǶȽ�����ԭ����___________________��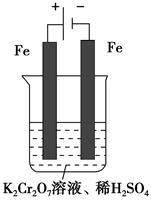
��(1)K�� ��(2)AC��(3)0.6
��(2)AC��(3)0.6
Fe(OH) 3����pH����4ʱ��c(OH��)��10��10 mol��L��1��c(Cr3��)��
10��32/c3(OH��)��10��2 mol��L��1��10��5 mol��L��1�����Cr3��û�г�����ȫ
(5)Fe��2e��===Fe2����2H����2e��===H2�����������ɵĽ����������������ƶ���������Ӧ������H����������ˮ�ĵ���ƽ�⣬�ٽ���ˮ�ĵ��룬ʹ��Һ��OH����Ũ��������Һ�ʼ���
����


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��һ���¶��£��������·�Ӧ��N2(g)��3H2(g)  2NH3(g)����ʼʱ�������N2��H2�����ʵ����ֱ���3.0 mol��6.0 mol��ƽ��ʱ����NH3�����ʵ�����2.4 mol����֪�������ݻ�Ϊ5.0 L������
2NH3(g)����ʼʱ�������N2��H2�����ʵ����ֱ���3.0 mol��6.0 mol��ƽ��ʱ����NH3�����ʵ�����2.4 mol����֪�������ݻ�Ϊ5.0 L������
(1)H2��ת������________��
(2)ƽ��ʱ���������N2�����������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����£�������Һ�� 0.1 mol?L-1 NH3��H2O �� 0.1 mol?L-1 NH4Cl�У�
��1����Һ�ٵ�pH 7�������������������������ԭ���ǣ� ���õ��뷽��ʽ��ʾ����
��2����Һ�ڳ� �ԣ���ᡱ��������С�����ˮ�ⷴӦ�����ȷ�Ӧ�����¿��� ����ٽ��������ơ���NH4Cl��ˮ�⡣
��3�����й���������Һ��c��NH4+�� ��������ȷ���� ������ĸ����
a��������Һ��c��NH4+�� ������0.1 mol?L-1
b��������Һ��c��NH4+�� ��С��0.1 mol?L-1
c��NH4Cl��Һ��c��NH4+�� С��NH3��H2O��Һ��c��NH4+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
2012��11��16�գ�5���к����������ڹ���ʡ�Ͻ������ǹ�����ͷ�������ڣ������ع������ų������飬5���к�������������������ȡů����CO�ж���������
(1)CO�ж�������CO��ѪҺ��Ѫ�쵰��Ѫ���ز��ַ�Ӧ����̼��Ѫ�쵰�ף���Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪCO��HbO2 O2��HbCO��ʵ�������c(HbCO)��ʹֻ��c(HbO2)��
O2��HbCO��ʵ�������c(HbCO)��ʹֻ��c(HbO2)�� ��Ҳ������˵��������ˡ���֪t ��ʱ������Ӧ��ƽ�ⳣ��K��200������β�O2��Ũ��ԼΪ1.0��10��2 mol��L��1����ʹc(HbCO)С��c(HbO2)��
��Ҳ������˵��������ˡ���֪t ��ʱ������Ӧ��ƽ�ⳣ��K��200������β�O2��Ũ��ԼΪ1.0��10��2 mol��L��1����ʹc(HbCO)С��c(HbO2)�� ��������β�CO��Ũ�Ȳ��ܳ���________mol��L��1��
��������β�CO��Ũ�Ȳ��ܳ���________mol��L��1��
(2)������������CO��صķ�Ӧ��
Fe(s)��CO2(g) FeO(s)��CO(g)����H��Q1��ƽ�ⳣ��K1
FeO(s)��CO(g)����H��Q1��ƽ�ⳣ��K1
Fe(s)��H2O(g) FeO(s)��H2(g)����H��Q2��ƽ�ⳣ��ΪK2
FeO(s)��H2(g)����H��Q2��ƽ�ⳣ��ΪK2
H2(g)��CO2(g) CO(g)��H2O(g)����H��Q3��ƽ�ⳣ��ΪK3
CO(g)��H2O(g)����H��Q3��ƽ�ⳣ��ΪK3
�ڲ�ͬ���¶���K1��K2��K3����ֵ���£�
| T/�� | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
 CO(g)��H2O(g)�Ѿ�������ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��________��
CO(g)��H2O(g)�Ѿ�������ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��2.0L�����ܱ������г���1.0mol PCl5�����¶�ΪTʱ�������·�Ӧ
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ��mol-1����Ӧ�����вⶨ�IJ������ݼ��±���
H=124kJ��mol-1����Ӧ�����вⶨ�IJ������ݼ��±���
| ʱ��t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3��/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪A(g)+B(g) C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| �¶ȣ��� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ
A(g)+B(g)��ƽ�ⳣ����ֵΪ �鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���������ǿ�������Ҫ��Ⱦ���������������Ⱦ�ж��ַ������ô������ɽ������ٷɻ�β���е�NO��COת���CO2��N2���䷴ӦΪ��2NO��2CO 2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��²�ò�ͬʱ���NO��COŨ�����±���
2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��²�ò�ͬʱ���NO��COŨ�����±���
| ʱ�䣨s�� | 0 | 2 | 4 |
| c��NO�� �� mol��L��1�� | 1.00��10��3 | 2.50��10��4 | 1.00��10��4 |
| c��CO�� �� mol��L��1�� | 3.60��10��3 | c�� | 2.70��10��3 |
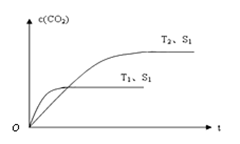
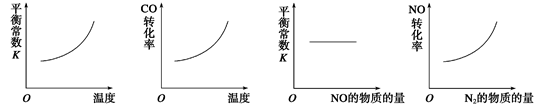
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����á���ѧ����ת�Ʒ����Ʊ�TaS2���壬�������·�Ӧ��
TaS2��s��+2I2��g�� TaI4��g��+S2��g�� ����
TaI4��g��+S2��g�� ����
ij�¶ȷ�Ӧ����K��4����ij�����ܱ������м���1mol I2��g��������TaS2��s����I2��g����ƽ��ת����Ϊ �� ��
��2������ͼ��ʾ����Ӧ������ʯӢ��չ��н��У������¶ȸߣ�T2����һ�˷���δ�ᴿ��TaS2��ĩ������I2��g��������һ��ʱ�������һ���¶ȵͣ�T1����һ�˵õ��˴�����TaS2���壬�������Ӧ�ġ�H 0���������������������Ӧ��ϵ��ѭ��ʹ�õ������� ��
��3����ͼΪ������ܵ�صĽṹʾ��ͼ���õ�صĹ����¶�Ϊ320�����ң���ط�ӦΪ2Na + xS��Na2Sx�������ĵ缫��ӦʽΪ____________________________��M����Na2O��Al2O3�Ƶã�������������________________________________________________����������
��4��д��Na2S��Һˮ������ӷ���ʽ_______________________________________��Na2S��Һ��c(H��)+ c(Na��)��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������һ����Ҫ�����ȼ�ϣ����������������������Գ��������ƻ����á���ҵ�Ͽ�����ˮú���ϳɶ����ѣ��䷴ӦΪ��3H2(g)��3CO(g)  CH3OCH3(g)��CO2(g) ��H<0
CH3OCH3(g)��CO2(g) ��H<0
��1����һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ���ֻ�ı�һ��������ͬʱ��߷�Ӧ���ʺ�CO��ת���ʵ���________������ĸ���ţ���ͬ����
a�������¶ȡ� b���������
c����С������� d������CO2��Ũ��
��2������Ӧ������㶨���ܱ������н��У��������жϷ�Ӧ�Ѵ�ƽ��״̬����________
a��3V��(CO2)��V��(CO) b������a mol CO2��ͬʱ����3a mol H2
c��������ܶȲ��ٸı� d����������ƽ����Է�����������
��3��300��ʱ�������Ϊ2L�������г���4 mol H2��6 mol CO��5minʱ����Ӧǡ�ô�ƽ�⣬��ʱH2��ת����Ϊ75%��
�� 5minʱV(CO)=_________mol/(L��min)�����¶��£��˷�Ӧ��ƽ�ⳣ��Ϊ��_______
�� �����¶Ȳ��䣬�������ѴﷴӦƽ��������У���ÿ������ͬʱ����1mol�����ʱƽ�⽫_______�ƶ����������������������
��4��.��ͼ�У���װ��ΪCH3OCH3��O2��KOH���߹��ɵ�ȼ�յ�أ���缫��ΪPt�缫��װ�����У�C��D�缫ΪPb�缫��������������PbSO4������ҺΪϡH2SO4��Һ��
�� д����װ����A���ĵ缫��Ӧʽ___________________________________________
�� д����װ����C���ĵ缫��Ӧʽ___________________________________________
�� ����23�˼��Ѳμӷ�Ӧʱ��D�缫�������仯Ϊ______�ˡ�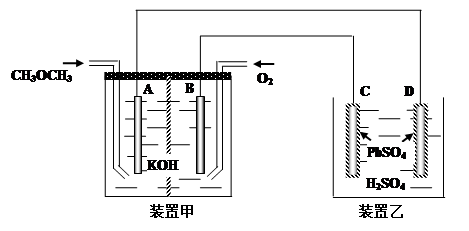
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com