
【题目】SF6是一种优良的绝缘气体,分子结构中只存在S﹣F键.已知:1mol S(s)转化为气态硫原子吸收能量280kJ,断裂1mol F﹣F、S﹣F键需吸收的能量分别为160kJ、330kJ.则S(s)+3F2(g)═SF6(g)的反应热△H为( )
A.﹣1780kJ/mol
B.﹣1220 kJ/mol
C.﹣450 kJ/mol
D.+430 kJ/mol
科目:高中化学 来源: 题型:
【题目】已知Cu2S与某浓度的硝酸反应时,生成硝酸铜和硫酸,若反应中Cu2S与HNO3的物质 的量之比为2:13,则该反应的还原产物为
A.N2O B.NO C.NO2 D.N2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中所列①~⑩元素,填写下列空白。
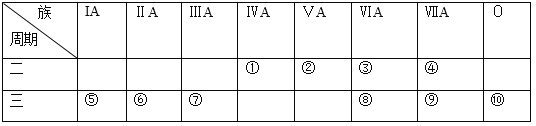
(1)单质性质最不活泼的元素是(填元素符号)_____。
(2)地壳中含量最多的元素在元素周期表中的位置为第_____周期_____族。
(3)元素①的气态氢化物中含有的化学键的类型为__________。
(4)第三周期元素的最高价氧化物对应水化物中,酸性最强的是(填化学式,下同)____________,具有两性的是_____________。
(5)元素⑦的氧化物与氢氧化钠溶液反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中正确的是 ( )
A. 在同一个电子层上运动的电子,其自旋方向肯定不同
B. 杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对
C. 物质的键能越大,该物质本身具有的能量越低
D. 在周期表中原子的族序数等于它的最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有M、A、B、D、N、E六种短周期元素,原子序数依次增大,M元素的单质是自然界最轻的气体,N元素的原子半径是所在周期中最大的,A、B、D、E四种元素在周期表中的相应位置如下图,它们的原子序数之和为37。下列说法不正确的是
![]()
A.A、B、D、E四种元素分别与M元素形成的简单化合物中,稳定性最强的是H2O
B.M、D、E、N形成的简单离子的半径大小:S2>O2>Na+>H+
C.A、B、D、M可组成多种含18电子的分子,如CH3OH、CH3CH3、CH3NH2等
D.B元素的氢化物与D元素的单质在一定条件下能发生置换反应,且氧化剂与还原剂的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,对其开发利用的部分流程如图所示。
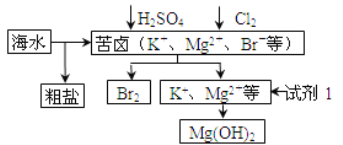
下列说法错误的( )
①试剂1可以选用NaOH溶液
②从苦卤中提取Br2的反应的离子方程式为:2Br - + Cl2=2Cl- + Br2
③工业上,电解熔融MgO冶炼金属镁可减小能耗
④制铝:工业上电解熔融氯化铝来制备铝
⑤制钠:电解饱和NaCl溶液
⑥炼铁:用CO在高温下还原铁矿石中的铁
A. ①③④⑥ B. ②③④⑥
C. ①③④⑥ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各组物质性质的比较中,正确的是
A. 硬度:Li>Na>K
B. 熔点:NaCl>CaO
C. 电负性:Na<Al<Mg
D. 空间利用率:体心立方堆积<六方堆积<面心立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质质量减小的是 ( )
A. 二氧化碳通过Na2O2粉末 B. 镁条在二氧化碳中燃烧
C. CO通过灼热的CuO粉末 D. 将铝粉投入CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下,HNO2电离反应的平衡常数值为2.6×10-4。NaNO2是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
选用药品 | 实验现象 | 利用NaNO2的性质 |
①酚酞试液 | ____________ | ____________ |
②淀粉-KI试纸 | ____________ | ____________ |
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为____________(填化学式)。
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。

已知: ①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为____________;
(2)C瓶内发生反应的离子方程式为____________。
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一组实验数据出现较明显异常,造成异常的原因可能是__________(填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为____________。
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小_______(简要说明实验步骤、现象和结论,仪器和药品自选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com