
完成下列方程式(24分)
(1)实验室制氯气 (2) 实验室制氨气
(3) 制漂白液 (4) 过量的铁与稀硝酸反应
(5) 过氧化钠与二氧化碳反应 (6)铝与氢氧化钠溶液反应
(7)氨气的催化氧化 (8)向氯化铁溶液中加入铜
(9)碳与浓硫酸反应 (10)制粗硅
(11)氯化亚铁溶液通氯气 (12)氢氧化铝溶于氢氧化钠溶液
(1)实验室制氯气 MnO2+4HCl(浓)=△=MnCl2+2H2O+Cl2↑ 催化剂
(2) 实验室制氨气 2NH4Cl+Ca(OH)2=△=CaCl2+2NH3↑+2H2O
(3) 制漂白液 Cl2+2NaOH===NaCl+NaClO+H2O
(4) 过量的铁与稀硝酸反应 3 Fe + 8 HNO3 ="3" Fe (NO3)2 +2NO↑+4H2O
(5) 过氧化钠与二氧化碳反应 2 Na2O2 + 2CO2=2Na2CO3 +O2
(6)铝与氢氧化钠溶液反应 2Al +2H2O+2NaOH =2NaAlO2 +3H2↑
|
解析


科目:高中化学 来源: 题型:


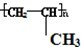
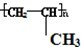


 ;若
;若 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)根据信息完成下列方程式。
(1) 化工厂为了检验输送氯气的管道是否漏气,用蘸有浓氨水的粗玻璃棒接近管道,根据是否有白烟产生来判断。用方程式表示其原理。
。
(2) FeSO4溶液在pH=2的硫酸溶液中,暴露在空气中是比较稳定的。如在该溶液中加入氧化亚铁硫杆菌后,大部分Fe2+离子可迅速转化成Fe3+(Fe3+是浸出硫化矿物的良好的出剂)。这一反应是细菌浸出矿物的重要反应之一,该反应方程式为:
。
(3) 四氢硼酸钠(NaBH4)是一种重要的广谱还原剂,写出它在碱性溶液中将Ru3+离子还原为金属的反应的离子方程式。
。
(4) 向KI和H2SO4的混合溶液中加入过氧化氢,放出大量不溶于水的无色气体,同时溶液呈棕黄色,可使淀粉变蓝。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
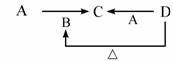
完成下列方程式:
(1)A→C:_________________;
(2)D→B:__________________;
(3)C→O3:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com