
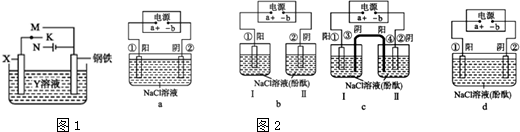
分析 (1)①若K为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;
②若K为锌,开关K置于a处,Zn为阳极被腐蚀,Fe为阴极被保护;
(2)根据原电池与电解池的形成条件分析,acd均形成闭合回路,正极相连的为阳极,负极相连的为阴极,b没能形成闭合回路.
解答 解:(1)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极,故K连接N处,故答案为:N;
②若X为锌,开关K置于M处,Zn为负极被腐蚀,Fe为正极被保护,该防护法称为牺牲阳极的阴极保护法,故答案为:M;
(2)电极材料均为铁,电解质均为NaCl溶液,根据原电池与电解池的形成条件分析,acd均形成闭合回路,正极相连的为阳极,负极相连的为阴极,能够形成电解池,能模拟金属管道的腐蚀原理,b没能形成闭合回路,不能模拟,c中铁作阳极,失去电子发生氧化反应,水中的氢离子得电子发生还原反应,总反应方程式为Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑,故答案为:acd;Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑.
点评 本题考查了原电池和电解池原理,正极相连的为阳极,负极相连的为阴极,根据各个电极上发生的反应来分析解答,难度中等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
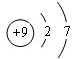 ,D离子的结构示意图:
,D离子的结构示意图: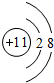 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
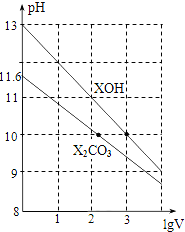
| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | 1×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3Cl和CCl4分子的空间构型均为正四面体 | |
| B. | 1,2-二氯乙烯有顺反异构体,CH3CCl=CHBr不存在顺反异构现象 | |
| C. | CH3CH=CHC≡CCF3分子中6个C原子都在同一平面上 | |
| D. | 苯的对位二元取代物只有一种说明苯分子中碳碳键不是单、双键相间交替 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com