
【题目】卤族元素随着原子序数的增大,下列递变规律正确的是( )
A. 原子半径逐渐增大B. 单质的氧化性逐渐增强
C. 单质熔、沸点逐渐降低D. 气态氢化物稳定性逐渐增强
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( ) ![]()
A.原子半径Z<M
B.Z位于元素周期表中第二周期、第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的小
D.Y的最高价氧化物对应水化物的酸性比X的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知3.01×1023个X 气体分子的质量为16g,则X气体的摩尔质量是 ( )
A. 16g B. 32g C. 64g.mol-1 D. 32g.mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2L的密闭容器中加入2molN2和6molH2 , 发生如下反应N2(g)+3H2(g)=2NH3(g)△H<0,5min后平衡测得c(NH)3=0.5mol/L
(1)该条件下此反应的化学平衡常数的表达式K= . 温度升高,则K值 . (填“变大”、“变小”或“不变”)
(2)若平衡时,移走1molN2和3molH2 , 在相同温度下再达平衡时c(NH3)0.25mol/L.(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表达式正确的是( )
A.CH3COOH溶液中CH3COOH的电离:CH3COOH=H ++CH3COO﹣
B.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2Cl﹣
Cu2++2Cl﹣
C.NaHCO3溶液中HCO3﹣的水解:HCO3﹣+H2 O?H3 O ++CO32﹣
D.将FeCl3溶液滴入Na2CO3溶液中:2Fe3++3 CO32 ̄+3 H2 O═2Fe(OH)3↓+3 CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl﹣KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( ) 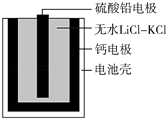
A.正极反应式:Ca+2Cl﹣﹣2e﹣═CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1 mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便。下列各组物质中,符合“氧化物—酸—碱—盐”顺序排列的是
A.CO HNO3 NaOH KNO3 B.CO2 H2CO3 Na2CO3 Ca(HCO3)2
C.H2SO4 HCl Mg(OH)2 MgCl2 D.SO3 NaHCO3 NaOH Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值,下列说法正确的是( )
A.1L 1 molL﹣1的Na2CO3 溶液中含有的阴离子数目大于NA
B.标准状况下,2.24LCCl4中含有共价键总数为0.4NA
C.常温常压下,18g D2O的原子总数为3NA
D.7.1g Cl2与足量的Fe反应,转移电子数目为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组拟用如图1装置制取Cl2(气密性已检验,试剂已添加),并研究其相关性质. 
(1)写出烧瓶内反应的化学方程式
(2)欲证明干燥的Cl2无漂白性而HClO有漂白性,实验方案为: .
(3)将生成的氯气通过图2装置: ①观察到图2丙中的现象是 . 能证明发生此变化是由HClO的漂白性引致的实验是 .
②取20mL图2乙中的溶液加入锥形瓶中,加入足量的KI溶液,以淀粉液为指示剂,用浓度为0.01000mol/L的Na2S2O3溶液滴定,消耗Na2S2O3溶液的体积为25.00mL.则饱和食盐水中Cl2的含量为g/L(忽略其中的HClO,结果保留4位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com