
分析 ①假设O2和O3的质量均为48g,根据n=$\frac{n}{M}$计算各自物质的量,分子数目之比等于其物质的量之比,均由O原子构成,则氧原子质量相等,含有O原子数目相等;
②假设O2和O3的体积均为22.4L,依据n=$\frac{V}{22.4L/mol}$计算各自物质的量,分子数目之比等于其物质的量之比,臭氧为3原子分子,氧气为双原子分子;依据m=nM计算各自质量;
③根据组分都为氧气,所以其质量与分子数成正比,计算cg气体的物质的量,最后根据气体体积公式求出体积,据此解答.
解答 解:①假设O2和O3的质量均为48g,
则O2的物质的量为$\frac{48g}{32g/mol}$=1.5mol,
O3的物质的量为$\frac{48g}{48g/mol}$=1mol,
故O2和O3所含分子个数比为1.5mol:1mol=3:2;
O2和O3均由O原子构成,则氧原子质量相等,含有O原子数目相等,即原子个数比为1:1,
O2和O3分子的物质的量之比为1.5mol:1mol=3:2,
故答案为:3:2;1:1;3:2;
②假设O2和O3的体积均为22.4L,依据n=$\frac{V}{22.4L/mol}$,氧气与臭氧的物质的量都为1mol;
O2和O3均由O原子构成,臭氧为3原子分子,氧气为双原子分子,含有O原子数目分别:2NA,3NA;原子个数比为:2:3;
氧气质量m(O2)=1mol×32g/mol=32g,臭氧的质量m(O3)=1mol×48g/mol=48g,二者质量之比:32:48=2:3;
故答案为:1:1;2:3;2:3;
③根据其组分都为氧气相同,所以其质量与分子数成正比,ag氧气含有的分子数为:b个,质量与分子数的比列式为:ag:b个=cg:x个,
x=$\frac{bc}{a}$个;
cg该混合气体含有的物质的量为:n=$\frac{bc}{a{N}_{A}}$mol其体积为:V=n×Vm =$\frac{bc}{a{N}_{A}}$mol×Vm =$\frac{22.4bc}{a{N}_{A}}$L.
故答案为:$\frac{22.4bc}{a{N}_{A}}$L.
点评 本题考查了有关阿伏伽德罗常数的计算,明确相关概念及计算公式是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.8 g Na2O2含有的阴离子数目为0.1 NA | |
| D. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
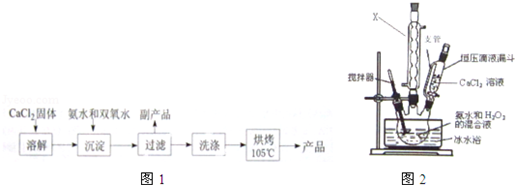
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl中少量的KNO3,可将固体混合物制成热饱和溶液,冷却结晶、过滤 | |
| B. | 探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生浑浊的快慢,来反映试剂反应速率的大小.从而探究浓度,温度等外界条件对该反应的化学反应速率的影响 | |
| C. | 在中和热的测定实验中,应将碱液缓慢倒入酸液中,使反应充分进行 | |
| D. | 为了加快反应速率得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
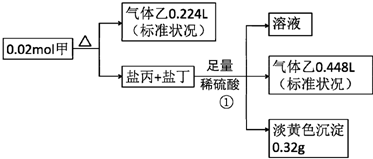
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
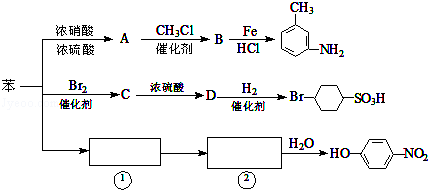
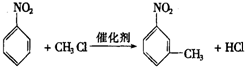 .
.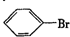 ,②
,②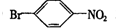 .
.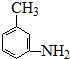 的所有原子不是(填“是”或“不是”)在同一平面上.
的所有原子不是(填“是”或“不是”)在同一平面上.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com