
下列反应的离子方程式书写正确的是
A.澄清石灰水与过量小苏打溶液混合:Ca2+ + OH- + HCO3-== CaCO3↓+H2O
B.碳酸钙溶于醋酸: CaCO3 + 2H+ =Ca2+ + CO2↑+ H2O
C.盛装氢氧化钠溶液的试剂瓶不可以用玻璃塞:SiO2+ 2Na+ +2 OH--= Na2SiO3+H2O
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2+ + 2OH- + NH4+ + H+ + SO42- = BaSO4↓+ NH3·H2O + H2O
科目:高中化学 来源:2015届陕西省宝鸡市岐山县高三上学期期中考试化学试卷(解析版) 题型:选择题
下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是
A.4HCl+MnO2===MnCl2+Cl2↑+2H2O
B.I2+2NaClO3===2NaIO3+Cl2
C.2CH3COOH+Ca(ClO)2===2HClO+Ca(CH3COO)2
D.Fe + 2H+===2Fe2+ + H2 ↑
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高二上学期期中考试化学试卷(解析版) 题型:填空题
以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为 (填化学式)而除去。
(2)①中加入的试剂应该选择 为宜,其原因是 。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)已知Fe(OH)3的Ksp=1×10-35mol4/L4 ;化学上通常认为残留在溶液中离子浓度小于1×10-5mol/L时,沉淀完全。方案③中a最小值为 .
(5)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.物质的量浓度和体积都相同的盐酸和醋酸溶液,在与足量锌反应时,起始时二者产生H2速率基本相等
B.100 mL 1 mol·L-1的盐酸和50 mL 2 mol·L-1的盐酸,分别与足量的锌反应时,两者放出H2速率和质量均相等
C.100 mL pH=3的H2SO4和HCl溶液,与足量锌反应后,放出H2的质量相等
D.100 mL pH=3的盐酸与醋酸溶液,与足量锌反应后,所得H2的质量相等
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:填空题
(8分)建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
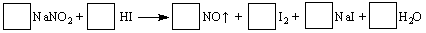
(1)配平上述反应方程式,将系数填入方框中。
(2)上述反应的氧化剂是 ,若反应中有5 mol电子转移,则生成NO在标准状况下的体积是 L。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水;②碘化钾淀粉试纸;③淀粉;④白酒;⑤食醋,进行实验,下列几组合适的是 。
A.③⑤ B.①②④ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
某无色透明的溶液中,下列各组离子能大量共存的是
A.H+、Cl-、Ba2+、CO32- B.Ag+、I-、K+、NO3-
C.K+、OH-、Cl-、Na+ D.Fe3+、Cl-、NO3-、Na+
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.气体摩尔体积不一定是22.4 L/mol
B.1 mol H2O(g)在标准状况下体积为22.4 L
C.1 mol气体体积为22.4 L,则一定是标准状况
D.1 mol任何气体所占体积都约是22.4 L
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省高三上学期10月月考试卷(解析版) 题型:选择题
将适量的MO2粉末投入热水中,一边搅拌,一边通入SO2气体,结果得到白色不溶物X,已知X既是氧化产物又是还原产物。下列判断错误的是 ( )
①MO2具有氧化性 ②白色不溶物X为MSO2
③白色不溶物X为MSO4 ④白色不溶物X为MS
A.①② B.③④ C.②④ D.①③
查看答案和解析>>
科目:高中化学 来源:2015届辽宁省大连市高三10月月考理综化学试卷(解析版) 题型:实验题
医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、A13+、Fe3+等杂质)生产医用二水合氯化钙晶体(CaCl2·2H2O的质量分数为97.3—103.0%),工艺流程为:
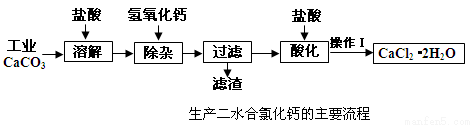
(1)CaCO3与盐酸反应的离子方程式 。
(2)①加入氢氧化钙溶液调节溶液的PH为8.0—8.5,此时A13+、Fe3+沉淀完全,则滤渣主要成分的化学式为 。
②过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。
(3)酸化时加盐酸将溶液的PH调节到4.0左右,其目的为:① ,
②防止Ca2+在蒸发时发生水解。
(4)操作Ⅰ中应包括 、 、过滤等实验步骤。
(5)为测定样品中CaCl2·2H2O的含量,称取0.735g样品配成250mL溶液,量取该溶液25.00mL于锥形瓶中,用0.05mol/L AgNO3溶液进行滴定,消耗AgNO3溶液的体积为20.40mL。
①通过计算,样品含CaCl2·2H2O的质量百分数为 (只写计算式不计算结果)。
②若所测样品CaCl2·2H2O的质量百分数偏高(忽略其它实验操作误差),可能的原因之一为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com