
(10分)把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
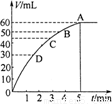
(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)A、B、C、D各点反应速率由快到慢的顺序是 。
(4)根据曲线形状解释反应速率变化的原因 。
(5)计算反应前过氧化氢的物质的量浓度
(1)60ml (2)2min (3)D.C.B.A
(4)随着过氧化氢浓度的减小,化学反应速率减小 (5)0.11mol·L-1
【解析】根据图像可知当反应进行到5min时,气体体积不再发生变化,所以实验中放出的气体体积为60ml。根据图像当反应进行到2min时,气体体积为30ml。根据图像曲线的变化趋势可以看出,最初阶段曲线的斜率最大,反应最快,随着时间的推移,反应速率逐渐减小。这是由于随着反应的进行,反应物的浓度逐渐降低,导致反应速率逐渐减小。60ml氧气的物质的量是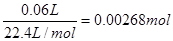 ,根据双氧水的分解方程式2H2O2=2H2O+O2↑可知消耗双氧水的物质的量是0.0054mol,所以其浓度为
,根据双氧水的分解方程式2H2O2=2H2O+O2↑可知消耗双氧水的物质的量是0.0054mol,所以其浓度为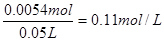 .
.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
(10分)把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)A、B、C、D各点反应速率由快到慢的顺序是 。
(4)根据曲线形状解释反应速率变化的原因 。
(5)计算反应前过氧化氢的物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省部分中学高一下学期期中考试化学试卷(带解析) 题型:填空题
(10分)把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。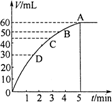
(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)A、B、C、D各点反应速率由快到慢的顺序是 。
(4)根据曲线形状解释反应速率变化的原因 。
(5)计算反应前过氧化氢的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com