
����Ŀ��ƫ������(C2H8N2)�� N2O4 �dz��õĻ���ƽ����������£�1mol Һ̬ C2H8N2�� 2mol Һ̬ N2O4 ��ȫ��Ӧ������ CO2��N2��H2O ��������Ⱦ�����ͬʱ�ͷų��ߴ� 2250kJ ��������
(1)ƫ�������� N2O4 ��Ӧ���Ȼ�ѧ����ʽΪ_____
(2)��Ӧ�е���������_____
(3)�������ʱ�����ֺ���ɫ���壬ԭ��Ϊ��N2O42NO2 ���¶�����ʱ��������ɫ�����÷�ӦΪ_____�ȷ�Ӧ(����������������)
(4)�ֽ� 1mol N2O4 ����һ�������ܱ������У�����ʾ��ͼ��ȷ����˵�� N2O42NO2�ﵽƽ��״̬����_____(����ĸ)
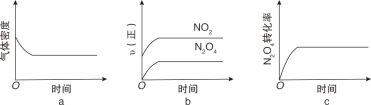
(5)���о�֮������ѧ�������ǽ������Ը�ǿ��F2��Ӧ���ʼ��졢�ͷ��������ߵ�N5 �����ƽ��������ۺϷ������δ���ã����������ƽ���Ӧ�߱����ص���_____
���𰸡�C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)��H=-2250kJ/mol N2O4 �� c ��λ�����ͷ������ߡ����ﻷ������Ӧ�ɿ�
��������
(1)1molҺ̬C2H8N2��2molҺ̬N2O4��ȫ��Ӧ������CO2��N2��H2O��������Ⱦ�����ͬʱ�ͷų�2250kJ���������ݴ˿�֪�÷�Ӧ���Ȼ�ѧ����ʽΪC2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)��H=-2250kJ/mol��
(2)�÷�Ӧ��N2O4�е�Ԫ�ػ��ϼ۽��ͣ�Ϊ��������
(3)�¶�����������ɫ���˵��ƽ�������ƶ���NO2Ũ���������Ը÷�ӦΪ���ȷ�Ӧ��
(4)a���÷�Ӧǰ����������������䣬�������ݣ������ܶ�һֱ���䣬��a����
b����ʼͶ��Ϊ1molN2O4������v(��)N2O4�ڳ�ʼʱ�̲�Ϊ0����b����
c��������������ת���ʲ��䣬˵�����淴Ӧ������ȣ��ﵽ��ƽ��״̬����c��ȷ��
��������ѡc��
(5)������Ŀ��Ϣ��֪û�в��������Ը�ǿ��F2��Ӧ���ʼ��졢�ͷ��������ߵ�N5 �����ƽ�����˵������ƽ���������Ҫ��λ�����ͷ������ߡ����ﻷ����������Ҫ��Ӧ�ɿء�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Һ������Fe2+��Cu2+��Cl-���л���ͭ���Ƶô�����FeCl3��Һ�������Ƶô�����FeCl3��ҺΪԭ����ȡ������ˮ�������������(K2FeO4)�����������£�

��֪���������(K2FeO4)λ����ɫ���壬������ˮ�������Ի�������Һ���ֽ⣬�ڼ�����Һ���ȶ���������ؾ���ǿ�����ԡ��������(K2FeO4)��ˮ���ò���Fe(OH)3��
��1�������Һ�к���Fe2+ѡ�õ��Լ���________���ѧʽ�����ӷ�Һ���Ƶô�����FeCl3��Һ������Լ��������⣬����Ҫһ���Լ���_________���ѧʽ��������ʱ������Ӧ�����ӷ���ʽΪ__________��
��2���������(K2FeO4)�ڴ���ˮ�����е�������_________��__________��
��3�������������̷�Ӧ�����ӷ���ʽΪ__________��
��4������ʱ���õIJ��������в��������ձ���________���������յõ��ĸ�����س�������־�������ؽᾧ���ᴿ�������ǣ����ֲ�Ʒ��_________�ܽ⣬Ȼ��________��
��5���û��յ�ͭΪԭ�Ͽ��Ƶô���CuSO4��5H2O���壨����������FeSO4��7H2O������ȥCuSO4��5H2O��������־�ķ����ǣ�����Һ�м���H2O2���ٵ�����ҺPH�����˼����Ƶô�����CuSO4��Һ�������Ƶô���CuSO4��5H2O�ľ��塣
��֪������ʱһЩ���ʵ�Kaq���±���
��ѧʽ | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0��10-16 | 8.0��10-18 | 8.0��10-20 |
��֪��Һ�е�����Ũ��С��1��10-6mol��L-1ʱ���϶�������ȫ��
��˫��ˮ��Ŀ����__________������Һ��CuSO4��Ũ��Ϊ3.0mol��L-1��ͨ������˵���˷����ɳ�ȥ����CuSO4��5H2O������FeSO4��7H2O������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1 mol O2(g)�еĻ�ѧ����Ҫ����498 kJ�����������������仯ʾ��ͼ������˵������ȷ����

A.2H2(g)��O2(g)��2H2O(l) ��H����480.4 kJ��mol��1
B.H2O(g)��H2(g)��![]() O2(g) ��H��240.2 kJ��mol��1
O2(g) ��H��240.2 kJ��mol��1
C.��1 mol H2(g)�еĻ�ѧ����Ҫ����436.4 kJ������
D.H2(g)��O2(g)�γ�H2O(g)�е�1 mol H��O���ų�462.8 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϣ����(![]() )��ɽ����(CH3CH=CH-CH=CH-COOH)���dz���ʳƷ�����������й������������������ȷ����
)��ɽ����(CH3CH=CH-CH=CH-COOH)���dz���ʳƷ�����������й������������������ȷ����
A.����ʹ��ˮ��ɫB.1mol��ֱ�������H2�ӳ�ʱ����H2�������
C.��Ϣ�����ɽ������ͬϵ��D.һ�������¶������Ҵ�����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̽��Ũ�ȶ�2Fe3+ + 2I-2Fe2+ + I2 ��Ӱ�죬��������ʵ�飺
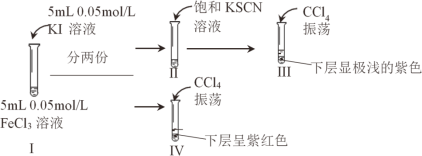
����˵������ȷ����
A.���м���� SCN-���Fe3+ʹƽ�������ƶ�
B.����� I2
C.�Ƚ�ˮ��Һ�е� c(I-)��II>��
D.�Ƚ�ˮ��Һ�е� c(Fe3+)����>I
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������½�1 mol N2��3 mol H2�����ܱ������з�����ӦN2+3H2![]() 2NH3(����Ӧ�Ƿ��ȷ�Ӧ)�����й��ڸ÷�Ӧ��˵����ȷ����
2NH3(����Ӧ�Ƿ��ȷ�Ӧ)�����й��ڸ÷�Ӧ��˵����ȷ����
A. �����¶ȿ��Լӿ췴Ӧ����
B. �ﵽ��ѧ��Ӧ��ʱ������2mol NH3
C. ���������ټ���N2���Լӿ췴Ӧ����
D. 1mol N2 ��3mol H2������������2mol NH3��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ѧϰС����ճ������в���ȱ�ٵĵ�ζƷM����̽������֪C����D��ȼ�շ�����ɫ���档M���������ʵ�ת����ϵ����ͼ��ʾ(���ֲ����Ӧ��������ȥ)��
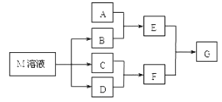
(1)�����£��ö��Ե缫���M��Һ(����)������Ӧ�����ӷ���ʽΪ__________�����һ��ʱ�������Һ��ԭ�ķ���Ϊ_____ ����M��ҺΪ0.5 L�����һ��ʱ�����������������1.12 L(������Ϊ��״���µ����)���������Һ��pHΪ_____(������Һ������仯)��
(2)��A��һ�ֳ�����������ˮ��������������������첣������E��Һ���׳���_______��
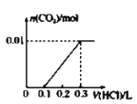
(3)��A��CO2���壬��һ������Aͨ��B��Һ���õ���ҺW��������ҺW�е������ᣬ�������ͼ��ʾ������ҺW�е����ʼ������ʵ����ֱ�Ϊ_____��_____��
(4)��A��һ�ֻ��ʡ�A��B��Ӧ����������E��E��D�����������̣���ҵ�Ͽ�����E��D�ķ�Ӧ�������D�Ĺܵ��Ƿ�й©������ΪE��D�ɷ�����Ӧ��_________(д��ѧ����ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ٴ�ʯ���л����Ŀǰ��ҵ������A����Ҫ;����A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ�����չˮƽ����2CH3CHO��O2![]() 2CH3COOH������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·������ͼ��ʾ��
2CH3COOH������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·������ͼ��ʾ��
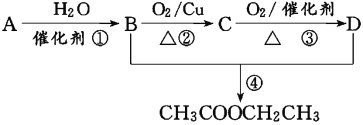
�ش��������⣺
��1��д��A�Ľṹ��ʽ______________________________��
��2��B��D�����еĹ��������Ʒֱ���________��________��
��3��д�����з�Ӧ�ķ�Ӧ���ͣ���________����________��
��4��д����Ӧ�ܵĻ�ѧ����ʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�

A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com