
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
分析 ①对于放热反应,温度越高,平衡逆向移动,反应平衡常数越小;
②根据浓度熵和平衡常数的关系来确定平衡的移动方向.
解答 解:①该反应正反应是放热反应,升高温度,平衡向逆反应方向移动,生成物浓度减小,反应物浓度增大,所以K1>K2,故答案为:>;
②400℃时,NH3和N2.H2的物质的量浓度分别为:$\frac{3mol}{0.5L}$=6mol/L、$\frac{1mol}{0.5L}$=2mol/L、$\frac{2mol}{0.5L}$=4mol/L,400℃时,浓度商Qc=$\frac{{6}^{2}}{2×{4}^{3}}$=$\frac{9}{32}$=0.28125<K=0.5,说明反应正向进行,因此有v(N2)正>v(N2)逆,
故答案为:>.
点评 本题考查化学平衡常数及影响因素、意义,题目难度中等,注意化学平衡常数大小说明反应进行程度,与反应难易无关、与反应速率无关.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新平衡时SO2的浓度是0.1mol•L-1 | |
| B. | 新平衡时NO2的转化率为20% | |
| C. | 新、旧平衡时容器内混合气体的平均相对分子质量之比为5:3 | |
| D. | 新、旧平衡时容器内气体的压强之比是5:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4amol•L-1 | B. | 0.8amol•L-1 | C. | 1.6a mol•L-1 | D. | 1.8a mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
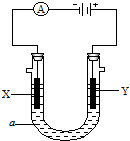
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量比1:1 | B. | 原子数比1:1 | C. | 分子数比1:1 | D. | 密度比1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol•L-1的氨水中含有的NH3分子数为0.1NA | |
| B. | 标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | |
| C. | 常温常压下,3.0g葡萄糖和冰醋酸的混合物中含有的原子总数为0.4NA | |
| D. | 标准状况下,Na2O2与足量CO2反应生成2.24L O2,转移电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,E反应物<E生成物 | |
| B. | CaCO3(s)═CaO(s)+CO2(g)△H=+178.5 kJ•mol-1,E反应物<E生成物 | |
| C. | HI(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,1 mol HI在密闭容器中分解后放出26.5 kJ的热量 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.2 kJ•mol-1,含1 mol NaOH水溶液与含0.5 mol的浓硫酸混合后放热57.2 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com