
| A. | 向某溶液中加入氯水,然后加入KSCN溶液,检验该溶液中是否含有Fe2+ | |
| B. | 向偏铝酸钠溶液中通入过量CO2,制备氢氧化铝 | |
| C. | 用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 | |
| D. | 用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱. |
分析 A.应该先加入硫氰化钾溶液,若没有现象再加入硫氰化钾,顺序不能颠倒;
B.偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀;
C.钠和水、乙醇反应剧烈程度不同;
D.根据钠盐的溶液酸碱性可比较酸性强弱,最高价含氧酸的酸性越强,对应元素的非金属性越强.
解答 解:A.向某溶液中加入氯水,然后加入KSCN溶液,无法证明原溶液中是否含有亚铁离子,应该先滴入硫氰化钾溶液,溶液没有现象,然后再加入氯水,故A错误;
B.氢氧化铝不溶于碳酸,向偏铝酸钠溶液中通入过量CO2可制备氢氧化铝,故B正确;
C.水中氢氧根离子和乙醇中的羟基氢活泼性不同,与钠反应剧烈程度不同,和水反应剧烈,和乙醇反应缓慢,可以利用和钠反应判断水和乙醇中羟基氢的活泼性强弱,故C正确;
D.测定Na2CO3、Na2SO4两溶液的pH,可比较水解程度,以此确定最高价氧化物对应的水化物的酸性强弱,可比较非金属性,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重于基本实验的操作的考查,涉及物质的检验和物质间的反应,题目难度不大,注意把握物质的性质以及实验的严密性和可行性的评价.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 35:56 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
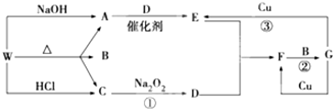
 ,F的颜色红棕色.
,F的颜色红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴化碘能与金属和非金属反应 | B. | 它可与水反应:IBr+H2O→HBrO+HI | ||
| C. | 它可KI溶液反应 KI+IBr→KBr+I2 | D. | 固体溴化碘是一种分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↓+H2 | |
| C. | 向次氯酸钙溶液通入过量CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | |
| D. | 硫酸氢铵与少量氢氧化钠溶液混合:NH4++HSO4-+2OH-═SO42-+NH3↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滤出的固体中一定含有银和铜,一定不含镁 | |
| B. | 滤出的固体中一定含有银,可能含有铜和镁 | |
| C. | 滤液中一定含有硝酸银和硝酸镁,一定没有硝酸铜 | |
| D. | 滤液中一定含有硝酸镁,一定没有硝酸银和硝酸铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com