
【题目】下列实验操作对应的现象与结论均正确的是( )
实验操作 | 现象 | 结论 | |
A | 常温下将 | 烧杯壁变凉 |
|
B | 向两支分别盛有 | 两支试管都有气泡产生 | 醋酸和硼酸的酸性比碳酸强 |
C | 将 | pH减小 | 稀释后 |
D | 常温下向物质的量浓度均为 | 先出现黄色沉淀 |
|
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___。
(2)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:___。
(3)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A.酸式滴定管未用标准盐酸润洗
B.滴定过程中不慎有液体溅出
C.滴定前仰视读数,滴定后读数正确
D.碱式滴定管未用待测液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2、NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)常温时,0.1molL-1NH4Al(SO4)2溶液的pH=3。
①溶液的Kw=______(填数值),由水电离的c(H+)=_____molL-1。
②溶液中c(NH4+)+c(NH3H2O)_____c(Al3+)+c(Al(OH)3)(填>”“=”“<”);
2c(SO42-)﹣c(NH4+)﹣3c(Al3+)=_______molL-1(计算式);
(2)80℃时,0.1molL-1NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是______;
(3)常温时,向100mL0.1molL-1NH4HSO4溶液中滴加0.1molL-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。
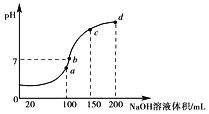
①图中a、b、c、d四个点中水的电离程度最小的是______。
②向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为______。
③NH4HSO4溶液中各离子浓度由大到小的排列顺序是_____。
(4)NH4Al(SO4)2可做净水剂,写出工业制金属铝的化学方程式______;
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为______;每消耗3.4gNH3转移电子的物质的量为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.常温下,![]() 的碱性溶液中不可能存在
的碱性溶液中不可能存在![]() 分子
分子
B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
C.![]() 溶液加水稀释,溶液的pH和
溶液加水稀释,溶液的pH和![]() 的电离度均增大
的电离度均增大
D.将![]() 溶液滴入含酚酞的
溶液滴入含酚酞的![]() 溶液,红色褪去,说明
溶液,红色褪去,说明![]() 溶液显酸性
溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的密闭容器中充入2 molX(g)和1 mol Y(g),发生反应2X(g) +Y(g) ![]() 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是

A.升高温度.平衡常数增大
B.W点Y的正反应速率等于M点Y的正反应速率
C.Q点时,Y的转化率最大
D.平衡时充入3molZ,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备(NH4)2Fe(SO4)26H2O的实验中,需对过滤出产品的母液pH<1进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入过量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com