
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| ||
| 6min |
| 2 |
| 15 |
| 2 |
| 15 |
| 4mol-2.4mol |
| 4mol |
| 2mol-1.6mol |
| 2mol |
| 0.4��0.4 |
| 1.6��0.6 |
| 2.8��10-9 |
| 1��10-4 |


 ��ҵ����ϵ�д�
��ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?�麣һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�����2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
��2013?�麣һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�����2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?����һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
��2013?����һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�| ʵ���� | �¶� �� |
��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
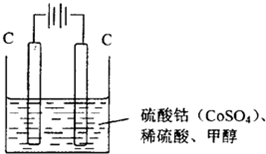 ��2013?̩��һģ���о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���壮
��2013?̩��һģ���о�̼���仯��������ʶԴٽ���̼���Ĺ���������Ҫ���壮| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ�������и����ڶ����ʼ����ۻ�ѧ�Ծ��������棩 ���ͣ������
����̼ѭ��������������ҵĸ߶����ӣ�����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2����Ϊ��ѧ���о�����Ҫ���⡣
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������������з�Ӧ
CO(g)��H2O(g) CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
ʵ���� | �¶��� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1��6 | 2��4 | 6 |
2 | 900 | 2 | 1 | 0��4 | 1��6 | 3 |
3 | 900 | a | b | c | d | t |
�� ʵ��2������ƽ�ⳣ��K=??????? ??? ��
�� ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵ_______(�����ֵ��ȡֵ��Χ)��
�� ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2 ��H2��Ϊ1mol�����ʱV��???? V��������<�� ����>�� ����=������
��2����֪�ڳ��³�ѹ����
��2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g)?? ��H����1275.6 kJ��mol
��2CO (g)+ O2(g) �� 2CO2(g)?? ��H����566.0 kJ��mol
��H2O(g) �� H2O(l)?? ��H����44.0 kJ��mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��____________
��3����֪������һ�ֶ�Ԫ���ᣬ�������ƣ�NaHC2O4����Һ�����ԡ������£���10 mL 0.01 mol��L-1 H2C2O4��Һ�еμ�10mL 0.01mol��L-1 NaOH��Һʱ���Ƚ���Һ�и�������Ũ�ȵĴ�С��ϵ??????????????? ��
��4��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10-9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10-4mol/L �������ɳ�������CaCl2��Һ����СŨ��Ϊ??????? _______________mol/L��
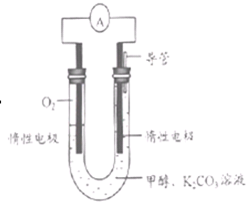
��5���Զ����ѣ�CH3OCH3����������H2SO4Ϊԭ�ϣ���Ϊ�缫�ɹ���ȼ�ϵ�أ��乤��ԭ�������ȼ�ϵ�ص�ԭ�����ơ���д���õ�ظ����ϵĵ缫��Ӧʽ��????????? ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ��ͷ�и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�������
������ЧӦ����ȫ���ע�Ļ�������֮һ��CO2��Ŀǰ�����к�����ߵ�һ���������塣��ˣ����ƺ�����CO2�ǽ������ЧӦ����Ч;����
��1������ͬ����CO(g)��H2O(g)�ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO(g)+H2O(g) CO2(g)+H2(g)���õ������������ݣ�
CO2(g)+H2(g)���õ������������ݣ�
|
ʵ���� |
�¶�/�� |
��ʼ��/mol |
ƽ����/mol |
�ﵽƽ������ʱ��/min |
||
|
CO |
H2O |
H2 |
CO |
|||
|
1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
|
2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
�� ʵ��1������ƽ�ⳣ��K= ������С������λ���֣���
�� ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a/b ��ֵ �������ֵ��ȡֵ��Χ����
�� ʵ��4����900��ʱ���ڴ������м���10molCO��5molH2O��2molCO2��5molH2�����ʱv(��) v(��)���<������>������=������
��2��CO2����Ȼ��ѭ��ʱ����CaCO3��Ӧ��CaCO3��һ���������ʣ���Ksp=2.8��10��9��CaCl2��Һ��Na2CO3��Һ��Ͽ��γ�CaCO3�������ֽ��������CaCl2��Һ��Na2CO3��Һ��ϣ���Na2CO3��Һ��Ũ��Ϊ2��10��4mo1/L�������ɳ�������CaCl2��Һ����СŨ��Ϊ ��
��3����֪BaSO4(s) + 4C(s) =4CO(g) + BaS(s) ��H1 =+571.2kJ/mol��
BaSO4(s) + 2C(s) = 2CO2(g) + BaS(s) ��H2=+226.2 kJ/mol��
��ӦC(s) + CO2(g) = 2CO(g)�ġ�H3= kJ/mol��
 ��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ��
��
�����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ
��(Li�����ԭ������ԼΪ7.0)
��4��Ѱ������Դ�ǽ������ЧӦ��һ����Ҫ˼·�����������LiFePO4��һ��������������ӵ�أ��ܷ�ӦΪ��FePO4+Li LiFePO4������еĹ������ʿɴ���Li+����õ�طŵ�ʱ������������Ӧʽ�ֱ�Ϊ��
��
�����øõ�ص������ˮ�����ص缫��Ϊ���Ե缫������������������3360mL���壨��״��������ʱ���õ������﮵�����Ϊ
��(Li�����ԭ������ԼΪ7.0)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com