
”¾ĢāÄæ”æÓŠ»śĪļAŹĒŅ»ÖÖÖŲŅŖµÄ»Æ¹¤ŌĮĻ£¬ŅŌAĪŖÖ÷ŅŖĘšŹ¼ŌĮĻ£¬ĶعżĻĀĮŠĶ¾¾¶æÉŅŌŗĻ³Éøß·Ö×Ó²Ä
ĮĻPA¼°PC”£

ŹŌ»Ų“šĻĀĮŠĪŹĢā
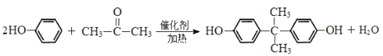
(1)BµÄ»ÆѧĆū³ĘĪŖ________£¬Bµ½CµÄ·“Ó¦Ģõ¼žŹĒ_____________”£
(2)Eµ½FµÄ·“Ó¦ĄąŠĶĪŖ__________£¬øß·Ö×Ó²ÄĮĻPAµÄ½į¹¹¼ņŹ½ĪŖ________”£
(3)ÓÉAÉś³ÉHµÄ»Æѧ·½³ĢŹ½ĪŖ______________________”£
(4)ŹµŃéŹŅ¼ģŃéÓŠ»śĪļA£¬æÉŃ”ŌńĻĀĮŠŹŌ¼ĮÖŠµÄ_____________”£
a£®ŃĪĖį b£®FeCl3ČÜŅŗ C£® NaHCO3ČÜŅŗ d£®ÅØäåĖ®
(5)EµÄĶ¬·ÖŅģ¹¹ÖŠ£¬¼ČÄÜÓėĢ¼ĖįĒāÄĘČÜŅŗ·“Ó¦”¢ÓÖÄÜ·¢ÉśŅų¾µ·“Ó¦µÄÓŠ»śĪļ¹²ÓŠ_____ÖÖ”£ĘäÖŠŗĖ“Ź²ÕńĒāŠ³Ķ¼ÓŠ5×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ6£ŗ1£ŗ1£ŗ1£ŗ1µÄĪļÖŹµÄ½į¹¹¼ņŹ½ĪŖ____”£
(6)ÓÉBĶعżČż²½·“Ó¦Öʱø1£®3£»·¼ŗ¶žĻ©µÄŗĻ³ÉĀ·ĻßĪŖ_________________”£
”¾“š°ø”æ»·¼ŗ“¼ ÅØĮņĖį”¢¼ÓČČ Ńõ»Æ·“Ó¦ 
 bd 12
bd 12 ![]()

”¾½āĪö”æ
ÓÉPCµÄ½į¹¹¼ņŹ½ÄęĶĘ£¬HµÄ½į¹¹¼ņŹ½ŹĒ £¬AÓė±ūĶŖ·“Ӧɜ³É
£¬AÓė±ūĶŖ·“Ӧɜ³É £¬æÉÖŖAŹĒ
£¬æÉÖŖAŹĒ![]() £»
£»![]() ÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³É
ÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³É![]() £¬C¾Ė«ŃõĖ®Ńõ»ÆÉś³É
£¬C¾Ė«ŃõĖ®Ńõ»ÆÉś³É![]() £¬CŹĒ
£¬CŹĒ![]() £»
£» £¬
£¬![]() µÄ½į¹¹¼ņŹ½ŹĒ
µÄ½į¹¹¼ņŹ½ŹĒ![]() £¬
£¬![]() Ė®½āĪŖ
Ė®½āĪŖ![]() ”£
ӣ
(1) ![]() ÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉB£¬BŹĒ
ÓėĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉB£¬BŹĒ![]() £¬»ÆѧĆū³ĘĪŖ»·¼ŗ“¼£¬
£¬»ÆѧĆū³ĘĪŖ»·¼ŗ“¼£¬![]() ŌŚÅØĮņĖį”¢¼ÓČȵÄĢõ¼žĻĀ·¢Éś“¼µÄĻūČ„·“Ӧɜ³É
ŌŚÅØĮņĖį”¢¼ÓČȵÄĢõ¼žĻĀ·¢Éś“¼µÄĻūČ„·“Ӧɜ³É![]() ”£
ӣ
(2)  ŹĒ
ŹĒ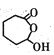 µÄ·Ö×ÓÖŠČ„µō2øöHŌ×Ó£¬·“Ó¦ĄąŠĶĪŖŃõ»Æ·“Ó¦£¬
µÄ·Ö×ÓÖŠČ„µō2øöHŌ×Ó£¬·“Ó¦ĄąŠĶĪŖŃõ»Æ·“Ó¦£¬![]() Óė¼ŗ¶ž°··¢ÉśĖõ¾Ū·“Ӧɜ³Éøß·Ö×Ó²ÄĮĻPA£¬PAµÄ½į¹¹¼ņŹ½ĪŖ
Óė¼ŗ¶ž°··¢ÉśĖõ¾Ū·“Ӧɜ³Éøß·Ö×Ó²ÄĮĻPA£¬PAµÄ½į¹¹¼ņŹ½ĪŖ ”£
ӣ
(3) ![]() Óė±ūĶŖ·“Ӧɜ³É
Óė±ūĶŖ·“Ӧɜ³É ŗĶĖ®£¬»Æѧ·½³ĢŹ½ĪŖ
ŗĶĖ®£¬»Æѧ·½³ĢŹ½ĪŖ ”£
ӣ
(4)AŹĒ±½·Ó£¬±½·ÓÓöFeCl3ČÜŅŗĻŌ×ĻÉ«£¬±½·ÓÓėÅØäåĖ®·“Ӧɜ³É°×É«³Įµķ2,4,6-Čżäå±½·Ó£¬ĖłŅŌŹµŃéŹŅ¼ģŃé±½·Ó£¬æÉŃ”ŌńFeCl3ČÜŅŗ»ņÅØäåĖ®£¬Ń”bd”£
(5)ÄÜÓėĢ¼ĖįĒāÄĘČÜŅŗ·“Ó¦ĖµĆ÷ŗ¬ÓŠōČ»ł”¢ÄÜ·¢ÉśŅų¾µ·“Ó¦ĖµĆ÷ŗ¬ÓŠČ©»ł£¬ ŗ¬ÓŠČ©»ł”¢ōČ»łµÄĶ¬·ÖŅģ¹¹ĢåÓŠ
ŗ¬ÓŠČ©»ł”¢ōČ»łµÄĶ¬·ÖŅģ¹¹ĢåÓŠ![]() ”¢
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ Ӣ
Ӣ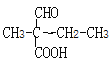 Ӣ
Ӣ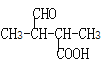 Ӣ
Ӣ![]() Ӣ
Ӣ![]() Ӣ
Ӣ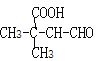 Ӣ
Ӣ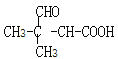 Ӣ
”¢![]() £¬¹²12ÖÖ”£ĘäÖŠŗĖ“Ź²ÕńĒāŠ³Ķ¼ÓŠ5×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ6£ŗ1£ŗ1£ŗ1£ŗ1µÄĪļÖŹµÄ½į¹¹¼ņŹ½ĪŖ
£¬¹²12ÖÖ”£ĘäÖŠŗĖ“Ź²ÕńĒāŠ³Ķ¼ÓŠ5×é·å£¬ĒŅ·åĆ껿֮±ČĪŖ6£ŗ1£ŗ1£ŗ1£ŗ1µÄĪļÖŹµÄ½į¹¹¼ņŹ½ĪŖ![]() ”£
ӣ
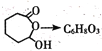
(6)ÓÉ»·¼ŗ“¼ŌŚÅØĮņĖį×÷ÓĆĻĀ·¢ÉśĻūČ„·“Ӧɜ³É»·¼ŗĻ©£¬»·¼ŗĻ©ÓėäåĖ®·¢Éś¼Ó³É·“Ӧɜ³É1,2-¶žäå»·¼ŗĶ飬1,2-¶žäå»·¼ŗĶéŌŚĒāŃõ»ÆÄʵē¼ČÜŅŗÖŠ¼ÓČČ·¢ÉśĻūČ„·“Ӧɜ³É1£®3£»·¼ŗ¶žĻ©£¬ÓÉ»·¼ŗ“¼ĶعżČż²½·“Ó¦Öʱø1£®3£»·¼ŗ¶žĻ©µÄŗĻ³ÉĀ·ĻßĪŖ ”£
ӣ


 Ģį·Ö°Ł·Ö°Ł¼ģ²ā¾ķµ„ŌŖĘŚÄ©²āŹŌ¾ķĻµĮŠ“š°ø
Ģį·Ö°Ł·Ö°Ł¼ģ²ā¾ķµ„ŌŖĘŚÄ©²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠĒ°ĖÄÖÜĘŚA£¬B£¬C£¬D£¬E”¢XĮłÖÖŌŖĖŲ£¬ŅŃÖŖB£¬C£¬D£¬E”¢AĪåÖÖ·Ē½šŹōŌŖĖŲŌ×Ó°ė¾¶ŅĄ“Ī¼õŠ”£¬ĘäÖŠBµÄsÄܼ¶ÉĻµē×Ó×ÜŹżµČÓŚpÄܼ¶ÉĻµē×Ó×ÜŹżµÄ2±¶£®XŌ×ÓµÄMÄܲćÉĻÓŠ4øöĪ“³É¶Ōµē×Ó£®Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³öC£¬D£¬EČżÖÖŌ×ÓµŚŅ»µēĄėÄÜÓɓ󵽊”µÄĖ³ŠņĪŖ__”£
£Ø2£©AŌ×ÓÓėB£¬C£¬DŌ×ÓŠĪ³É×ī¼ņµ„»ÆŗĻĪļµÄĪČ¶ØŠŌÓÉĒæµ½ČõµÄĖ³ŠņĪŖ__£¬øł¾Ż¼Ū²ćµē×Ó¶Ō»„³āĄķĀŪŌ¤²āBA2DµÄ·Ö×Ó¹¹ŠĶĪŖ__”£
£Ø3£©Ä³Ą¶É«¾§Ģ壬Ęä½į¹¹ĢŲµćŹĒX2+”¢X3+Ąė×Ó·Ö±šÕ¼¾ŻĮ¢·½Ģ廄²»ĻąĮŚµÄ¶„µć£¬¶ųĮ¢·½ĢåµÄĆæĢõĄāÉĻ¾łÓŠŅ»øöBC©£®ÓėAĶ¬×åĒŅĻą²īĮ½øöÖÜĘŚµÄŌŖĖŲRµÄĄė×ÓĪ»ÓŚĮ¢·½ĢåµÄĒ”µ±Ī»ÖĆÉĻ£¬øł¾ŻĘä½į¹¹ĢŲµćæÉÖŖøĆ¾§ĢåµÄ»ÆѧŹ½ĪŖ____£ØÓĆ×ī¼ņÕżÕūŹż±ķŹ¾£©”£
£Ø4£©æĘѧ¼ŅĶعżXÉäĻßĢ½Ć÷£¬KCl”¢MgO”¢CaO”¢TiNµÄ¾§Ģå½į¹¹ÓėNaClµÄ¾§Ģå½į¹¹ĻąĖĘ£ØČēÓŅĶ¼ĖłŹ¾£©£¬ĘäÖŠ3ÖÖĄė×Ó¾§ĢåµÄ¾§øńÄÜŹż¾ŻČēĻĀ±ķ£ŗ

øł¾Ż±ķøńÖŠµÄŹż¾Ż£ŗÅŠ¶ĻKCl”¢MgO”¢TiN ČżÖÖĄė×Ó¾§ĢåČŪµć“Óøßµ½µĶµÄĖ³ŠņŹĒ__£¬MgO¾§ĢåÖŠŅ»øöMg2+ÖÜĪ§ŗĶĖü×īĮŚ½üĒŅµČ¾ąĄėµÄO2©ÓŠ__øö”£
£Ø5£©ŃŠ¾æĪļÖŹ“ÅŠŌ±ķĆ÷£ŗ½šŹōŃōĄė×Óŗ¬Ī“³É¶Ōµē×ÓŌ½¶ą£¬Ōņ“ÅŠŌŌ½“󣬓żĒĀ¼ŠŌÄÜŌ½ŗĆ£¬Ąė×ÓŠĶŃõ»ÆĪļV2O5ŗĶCr2O3ÖŠ£¬ŹŹŗĻ×÷Ā¼Ņō“ų“Å·ŪŌĮĻµÄŹĒ__”£

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĘū³µĪ²ĘųµÄÖĪĄķŹĒ¼õĒįæÕĘųĪŪČ¾µÄÓŠŠ§Ķ¾¾¶”£æĘѧ¼ŅŃŠ¾æ·¢ĻÖTiO2µÄ»ģÄżĶĮ»ņĮ¤ĒąæÉŅŌŹŹ¶ČĻū³żĘū³µĪ²ĘųÖŠµÄµŖŃõ»ÆĪļ£¬ĘäŌĄķČēĻĀ”£ĻĀĮŠ¹ŲÓŚ”°Ļū³ż”±¹ż³ĢµÄŠšŹö“ķĪóµÄŹĒ

A. ²æ·Ö¹āÄÜ×Ŗ±äĪŖ»ÆѧÄÜ
B. Ļū³ż×Ü·“Ó¦ĪŖ£ŗ4NOx£«£Ø5£2x£©O2£«2H2O![]() 4HNO3
4HNO3
C. Ź¹ÓĆÄÉĆ×TiO2£¬²śÉśµÄ¹āÉśµē×ÓŗĶæÕŃØøü¶ą£¬NOxĻū³żŠ§ĀŹøüøß
D. 1 mol![]() ±Č1 molōĒ»ł£Ø”¤OH£©¶ą9NAøöµē×Ó£ØNAĪŖ°¢·üŁ¤µĀĀŽ³£Źż£©
±Č1 molōĒ»ł£Ø”¤OH£©¶ą9NAøöµē×Ó£ØNAĪŖ°¢·üŁ¤µĀĀŽ³£Źż£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚĻĀĮŠ·“Ó¦ÖŠ£¬µ„ÖŹÖ»×÷Ńõ»Æ¼ĮµÄŹĒ
A.2F2+2H2OØT4HF+O2”ü
B.Cl2+2NaOHØTNaCl+NaClO+H2O
C.2Na+2H2OØT2NaOH+H2”ü
D.H2+CuO![]() H2O+Cu
H2O+Cu
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ“×ĖįČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗāCH3COOH![]() H++CH3COO-£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
H++CH3COO-£¬ĻĀĮŠŠšŹö²»ÕżČ·µÄŹĒ
A. ÉżøßĪĀ¶Č£¬Ę½ŗāÕżĻņŅĘ¶Æ£¬“×ĖįµÄµēĄė³£ŹżKaÖµŌö“ó
B. 0.l0mol/LµÄCH3COOHČÜŅŗÖŠ¼ÓĖ®Ļ”ŹĶ£¬ČÜŅŗÖŠc(OH-)Ōö“ó
C. CH3COOHČÜŅŗÖŠ¼ÓÉŁĮæµÄCH3COONa¹ĢĢå£¬Ę½ŗāÄęĻņŅʶÆ
D. ŹŅĪĀĻĀ£¬ÓūŹ¹0.1mol/L“×ĖįČÜŅŗµÄpH£¬µēĄė¶Ča¶¼¼õŠ”£¬æɼÓČėÉŁĮæĖ®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŌLiPF6ŗĶSO(CH3)2ĪŖµē½āÖŹµÄøßÄÜļ®µē³ŲµÄ×Ü·“Ó¦Ź½ĪŖ2Li+FeS=Fe+LiS£¬ÓĆøƵē³ŲĪŖµēŌ“½ųŠŠČēĶ¼µÄµē½āŹµŃ飬µē½āŅ»¶ĪŹ±¼ä²āµĆ¼×µē³Ų²śÉś±ź×¼×“æöĻĀH24.48L”£ĻĀĮŠÓŠ¹ŲŠšŹöÕżČ·µÄŹĒ

A. Yµē¼«ĪŖøßÄÜļ®µē³ŲµÄøŗ¼«“ÓøōĤ֊ĶعżµÄĄė×ÓŹżÄæĪŖ0.4NA
B. µē½ā³ŲÖŠ»»³ÉŅõĄė×Ó½»»»Ä¤£¬×Ü·“Ó¦²»·¢Éś±ä»Æ
C. Čōµē½ā¹ż³ĢĢå»ż±ä»ÆŗöĀŌ²»¼Ę£¬Ōņµē½āŗó¼×³ŲÖŠČÜŅŗÅضČĪŖ4mol/L
D. µēŌ“Õż¼«·“Ó¦Ź½ĪŖ:FeS+2Li++2e-=Fe+Li2S
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¼×Ķ锢ŅŅĻ©ŹĒĮ½ÖÖÖŲŅŖµÄÓŠ»ś»ÆŗĻĪļ£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¹¤ŅµÉĻŅŌŅŅĶé(C2H6)ĪŖŌĮĻ£¬ÓĆ“«Ķ³µÄČČĮŃ½ā·Ø»ņĻÖŌŚµÄŃõ»ÆĮŃ½ā·ØÖĘČ”ŅŅĻ©£ŗ
¢ŁC2H6(g)=C2H4(g) +H2(g) ¦¤H1=+136kJ/mol£»
¢Ś2C2H6(g)+O2(g)=2C2H4(g)+2H2O(g) ¦¤H2=-220kJ/mol
ŅŃÖŖÉĻŹö·“Ó¦ÖŠ²æ·Ö»Æѧ¼ü¼üÄÜŹż¾ŻČēĻĀ±ķ£ŗ
»ÆѧÄÜ | H-H(g) | H-O(g) | O=O(g) |
¼üÄÜ( kJ/mol) | 436 | a | 496 |
ÓÉ“Ė¼ĘĖća=_________”£
(2)¼×ĶéæÉÓĆÓŚĻū³żµŖŃõ»ÆĪļNO2£ŗCH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)£¬ŌŚĪĀ¶ČĪŖT1ŗĶT2Ź±£¬·Ö±š½µ0.5molCH4ŗĶ1.2molNO2³äČė1LŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬²āµĆÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
N2(g)+CO2(g)+2H2O(g)£¬ŌŚĪĀ¶ČĪŖT1ŗĶT2Ź±£¬·Ö±š½µ0.5molCH4ŗĶ1.2molNO2³äČė1LŗćČŻĆܱÕČŻĘ÷ÖŠ·¢Éś·“Ó¦£¬²āµĆÓŠ¹ŲŹż¾ŻČēĻĀ±ķ£ŗ
ĪĀ¶Č | ĪļÖŹµÄĮæ Ź±¼ä/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
¢ŁĪĀ¶ČĪŖT1Ź±£¬0”Ŗ10minÄŚNO2µÄĘ½¾ł·“Ó¦ĖŁĀŹv(NO2)=__________________”£
¢Śøł¾Ż±ķÖŠŹż¾ŻÅŠ¶ĻT1 _________T2(Ģī”°£¾”±”°£¼”±»ņ”°=”±)£¬µ±ĪĀ¶ČĪŖT2Ź±·“Ó¦½ųŠŠµ½40minŹ±£¬x_______0.15(Ģī”°£¾”±”°£¼”±»ņ”°=”±)£¬øĆ·“Ó¦ĪŖ_________(Ģī”°·ÅČČ”±»ņ”°ĪüČČ”±)·“Ó¦”£
¢Ūµ„Ī»Ź±¼äÄŚŠĪ³ÉC”ŖH¼üÓėŠĪ³ÉC==OŃõ¼üµÄŹżÄæÖ®±ČĪŖ_________Ź±£¬ĖµĆ÷·“Ó¦“ļµ½Ę½ŗāדĢ¬”£
¢ÜĪĀ¶ČĪŖT2Ź±£¬ČōĻąĘ½ŗāŗóµÄČŻĘ÷ÖŠŌŁ³äČė0.5molCH4ŗĶ1.2molNO2£¬ÖŲŠĀ“ļµ½Ę½ŗāŹ±£¬n(N2)µÄ·¶Ī§ŹĒ__________________”£
(3)¼×Ķ锢ŅŅĻ©ĶźČ«Č¼ÉÕ¾łÉś³ÉCO2£¬³£ĪĀĻĀH2CO3![]() H++HCO3- Ka1=4.3”Į10-7£»HCO3-
H++HCO3- Ka1=4.3”Į10-7£»HCO3-![]() H++CO3-2- Ka2=5.6”Į10-11£»NH3”¤H2O
H++CO3-2- Ka2=5.6”Į10-11£»NH3”¤H2O![]() NH4++OH- Kb=1.8”Į10-5£»ÓĆ°±Ė®ĪüŹÕCO2Éś³ÉNH4HCO3ČÜŅŗ£¬ŌņNH4HCO3ČÜŅŗĻŌ_________(Ģī”°ĖįŠŌ”±”°¼īŠŌ”±»ņ”°ÖŠŠŌ”±)£¬¼ĘĖć·“Ó¦NH4++HCO3-+H2O
NH4++OH- Kb=1.8”Į10-5£»ÓĆ°±Ė®ĪüŹÕCO2Éś³ÉNH4HCO3ČÜŅŗ£¬ŌņNH4HCO3ČÜŅŗĻŌ_________(Ģī”°ĖįŠŌ”±”°¼īŠŌ”±»ņ”°ÖŠŠŌ”±)£¬¼ĘĖć·“Ó¦NH4++HCO3-+H2O![]() NH3”¤H2O+H2CO3µÄĘ½ŗā³£ŹżK=_________(½į¹ū±£ĮōŠ”Źżµćŗó1Ī»)
NH3”¤H2O+H2CO3µÄĘ½ŗā³£ŹżK=_________(½į¹ū±£ĮōŠ”Źżµćŗó1Ī»)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ ½«Ļ” HClČÜŅŗµĪ¼Óµ½µČÅØ¶ČµÄČõ¼ī AOHČÜŅŗÖŠ£¬ ²āµĆ»ģŗĻŅŗµÄ pHŗĶlg[C(AOH)/C(A+)] µÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ ĘäÖŠ aµć±ķŹ¾Ī“¼ÓŃĪĖįŹ±µÄŹż¾Ż£¬ eµć±ķŹ¾ HClŗĶ AOHĒ”ŗĆĶźČ«·“Ó¦Ź±µÄŹż¾Ż”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ

A. ³£ĪĀĻĀ£¬ A+µÄĖ®½āĘ½ŗā³£ŹżĪŖ 1.0”Į10£10
B. µćeČÜŅŗÖŠĖ®µēĄė³öµÄH+ÅضČĪŖ 10£6.23mol/L
C. µćc ČÜŅŗÖŠµÄ n(A+)+n(AOH)µČÓŚµć eČÜŅŗÖŠµÄ n(Cl£)
D. µćdČÜŅŗÖŠ£ŗ c(Cl£)> c(AOH)>c(A+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ80”ꏱ£¬1L ĆܱÕČŻĘ÷ÖŠ³äČė0.20 mol N2O4£¬·¢Éś·“Ó¦N2O4![]() 2NO2 ”÷H = + Q kJ”¤mol©1(Q£¾0)£¬»ńµĆČēĻĀŹż¾Ż£ŗ
2NO2 ”÷H = + Q kJ”¤mol©1(Q£¾0)£¬»ńµĆČēĻĀŹż¾Ż£ŗ
Ź±¼ä/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(NO2)/mol”¤L©1 | 0.00 | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
A. ÉżøßĪĀ¶ČøĆ·“Ó¦µÄĘ½ŗā³£ŹżK¼õŠ”
B. 20”«40s ÄŚ£¬v(N2O4)= 0.004 mol”¤L£1”¤s£1
C. 100sŹ±ŌŁĶØČė0.40 mol N2O4£¬“ļŠĀĘ½ŗāŹ±N2O4µÄ×Ŗ»ÆĀŹŌö“ó
D. ·“Ó¦“ļĘ½ŗāŹ±£¬ĪüŹÕµÄČČĮæĪŖ0.15Q kJ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com