
| A. | 向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 | |
| B. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol•L-1H2SO4溶液,试管口出现红棕色气体,说明溶液中NO3-被Fe2+还原为NO2 | |
| C. | 将某气体通入品红溶液中,品红褪色,说明该气体一定是SO2 | |
| D. | 将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀 |
分析 A.氢氧化铝可与酸反应;
B.试管口出现红棕色气体,为一氧化氮与氧气反应生成红棕色的二氧化氮;
C.氯水有漂白性;
D.二氧化碳、二氧化硫不能与氯化钡反应.
解答 解:A.氯化铝能与氨水反应生成氢氧化铝沉淀,氢氧化铝可与酸反应,故A正确;
B.在酸性条件下,Fe2+与NO3-发生氧化还原反应,3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,对于该反应Fe2+为还原剂,NO3-为氧化剂,被还原成NO,试管口出现红棕色气体,为一氧化氮与氧气反应生成红棕色的二氧化氮,故B错误;
C.氯水有漂白性,能使品红褪色,故C错误;
D.二氧化碳、二氧化硫不能与氯化钡反应,无沉淀,故D错误.
故选A.
点评 本题考查较为综合,涉及物质的性质实验,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤,注重相关基础知识的积累,难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:填空题
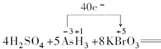
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
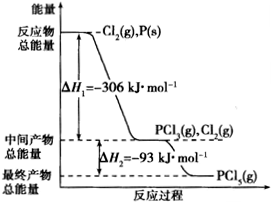 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 任何气体的体积都约为22.4L | |
| B. | 1mol 任何物质在标准状况下所占的体积都约是22.4L | |
| C. | 标准状况下,1mol 水所占有的体积是22.4 L | |
| D. | 标准状况下,22.4L的任何气体的物质的量都约是1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
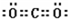 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
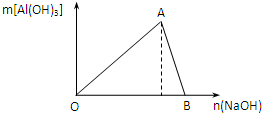
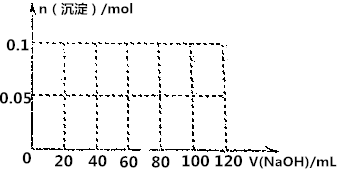
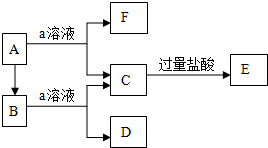
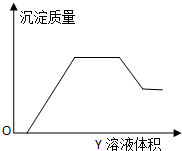 向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图象的是( )| 甲 | 乙 | |
| A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
| C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
| D | NaAlO2、氨水、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com