
分析 无色澄清溶液不含有Fe3+,
①用pH试纸检验,显红色,说明呈酸性,含有H+,则不含有CO32-;
②取部分溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色,说明含有I-;
③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,则不含SO42-,以此解答该题.
解答 解:无色澄清溶液不含有Fe3+,
①用pH试纸检验,显红色,说明呈酸性,含有H+,则不含有CO32-;
②取部分溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色,说明含有I-;
③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成,说明含有Ba2+,则不含SO42-,
以上实验不能确定是否含有K+,
故答案为:H+、Ba2+、I-;Fe3+、CO32-、SO42-;K+.
点评 本题考查了常见的离子检验方法,为高频考点,题目难度中等,涉及的离子之间的反应较多,注意根据有关离子间的反应和现象分析,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
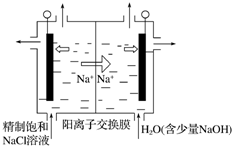 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
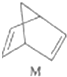 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$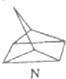 △H═88.6kJ•mol-1
△H═88.6kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从石油中得到各成分,可用蒸馏的方法,蒸馏为物理方法 | |
| B. | 提取溴水中的溴,可用加入乙醇萃取的方法 | |
| C. | 只含有泥沙的粗盐,可通过溶解、过滤、结晶的方法提纯 | |
| D. | 储存FeCl2溶液,需向试剂瓶中加入一定量的铁屑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com