
| A. | HNO3溶液 | B. | NaOH溶液 | C. | H2SO4溶液 | D. | 盐酸 |
分析 200.0mL 2.0mol•L-1的某溶液中溶质的物质的量为0.2L×2.0mol•L-1=0.4mol,Al的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,利用反应判断金属过量,并生成氢气即可.
解答 解:200.0mL 2.0mol•L-1的某溶液中溶质的物质的量为0.2L×2.0mol•L-1=0.4mol,Al的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,
A、因Al与HNO3溶液不生成氢气,则不符合题意,故A错误;
B、由2Al+2OH-+2H2O═2AlO2-+3H2↑,0.2molAl与0.4molNaOH溶液溶液反应时,碱过量,故B错误;
C、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molH2SO4溶液,硫酸过量,故C错误;
D、由2Al+6H+═2Al3++3H2↑,0.2molAl与0.4molHCl溶液,Al过量,故D正确;
故选D.
点评 本题考查铝的化学性质,明确铝与酸碱发生的化学反应是解答的关键,并注意利用量来判断过量问题即可解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M2、W2Z2均为共价化合物 | |
| C. | 由X元素形成的单质不一定是原子晶体 | |
| D. | 由Y、Z、M三种元素形成的化合物一定只有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
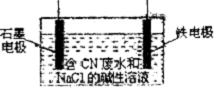 金属铝、铁、铜及其化合物与生产、科研关系密切.
金属铝、铁、铜及其化合物与生产、科研关系密切.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a>7 | B. | c(CH3COOH)-c(OH-)>10-amol/L | ||
| C. | c(Na+)=c(CH3COOH)+c(CH3COO-) | D. | c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①②③ | B. | 只有①②④ | C. | 只有③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 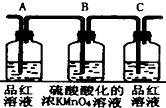 | 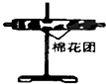 |  | 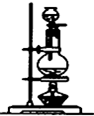 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com