
【题目】利用甲烷与氯气发生反应制取盐酸的设想,在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如下:
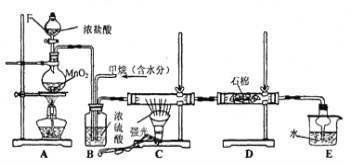
根据要求填空:
(1)装置A中反应的离子方程式为 ;
(2)B装置有三种功能:
①控制气流速度;② ;③ 。
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式 。
(4)D装置中的石棉上均匀附着湿润的KI粉末,其作用是 ,
E装置的作用是 。
(5)装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法为 ;
该装置还有缺陷,原因是没有进行尾气处理,写出尾气中的主要成分是 。
(填编号)
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
(6)实验之余,该学习小组进一步探究甲烷与氯气反应的条件。

通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按上图安装好装置,并夹紧弹簧夹a和b。过一段时间,打开弹簧夹a、b,I、II中观察到现象是 。
【答案】(1) MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2) 使气体混合均匀 ,干燥气体
(3)CH4 + 2Cl2![]() C + 4HCl
C + 4HCl
(4)吸收未反应的氯气 吸收HCl,防止倒吸
(5)分液 A,B
(6)在I瓶中:颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中
【解析】
试题分析:(1)MnO2能将浓HCl氧化为MnCl2和Cl2,离子方程式为MnO2+4H++2Cl—![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)浓硫酸可以干燥氯气和氯化氢,该装置还可使气体混合均匀;
(3)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,应为碳,化学方程式为CH4 + 2Cl2![]() C + 4HCl;
C + 4HCl;
(4)氯气能将碘化钾氧化为碘单质,石棉上均匀附着湿润的KI粉末可吸收未反应的氯气;E装置在吸收氯化氢时可防止倒吸;
(5)E装置中除了有盐酸生成外,还含有不溶于水的有机物,能分层,可用分液方法分离;反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷是气体,还可能有过量的甲烷,所以尾气中的主要成分是AB;
(6)II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处,则II瓶内气体为发生反应,I瓶内反应,气体体积减少,若打开弹簧夹a、b,I、II中观察到现象是在I瓶中:颜色逐渐变浅,且有油状液体产生,出现白雾,并可以看见水倒吸入I瓶中。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
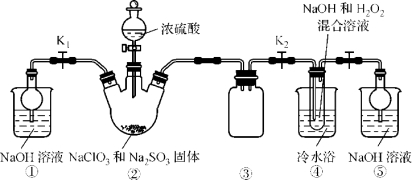
(1)装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为 。
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质] 化学作为一门基础自然科学,在材料科学、生命科学、能源科学等诸多领域发挥着重要作用。
(1)高温超导材料钇钡铜氧的化学式为YBaCu3O7,其中1/3的Cu以罕见的Cu3+形式存在。Cu在元素周期表中的位置为____ ,基态Cu3+的核外电子排布式为_ _______。
(2)磁性材料在生活和科学技术中应用广泛。研究表明,若构成化合物的阳离子有未成对电子时,则该化合物具有磁性。下列物质适合作录音磁带磁粉原料的为____(填选项字母)。
A.V2O5 | B.CrO2 | C.PbO | D.ZnO |
(3)屠呦呦因在抗疟药——青蒿素研究中的杰出贡献,成为首获科学类诺贝尔奖的中国人。青蒿素的结构简式如图l所示,其组成元素的电负性由大到小的顺序为 ;碳原子的杂化方式有____ 。
(4)“可燃冰”因储量大、污染小被视为未来石油的替代能源,由甲烷和水形成的“可燃冰”结构如图2所示。
①“可燃冰”中分子间存在的2种作用力为 。
②H2O的VSEPR模型为 ,比较键角的大小:H2O CH4(填“>”“<”或“=”),原因为 。
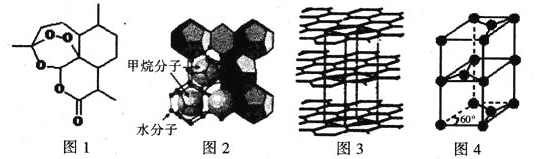
(5)锂离子电池在便携式电子设备以及电动汽车、卫星等领域显示出广阔的应用前景,该电池负极材料为石墨,石墨为层状结构(如图3),其晶胞结构如图4所示,该晶胞中有 个碳原子。已知石墨的层间距为apm,C-C键长为b pm,阿伏伽德罗常数的值为NA,则石墨晶体的密度为 g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途。

(1)写出Se的基态原子的外围电子排布式 。
(2)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如下图所示)中羧基氧原子的轨道杂化类型分别是 ,1 mol酒石酸中π键的数目是 。
(3)TiCl4熔点是—25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于 晶体;
NO3-离子的空间构型为 。
(4)主族元素A和钛同周期,具有相同的最外层电子数,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键。元素A、元素B和钛三者形成的晶体的晶胞如图所示,写出该晶体的化学式 (用元素符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型图。图中的“棍”代表单键或双键,不同大小的“球”代表三种不同的短周期元素的原子。对该有机物的叙述错误的是
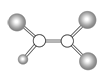
A.该有机物可能的分子式为C2HCl3
B.该有机物的分子中一定有碳碳双键
C.该有机物可以由乙烯和氯化氢加成反应得到
D.该有机物分子中的所有原子在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
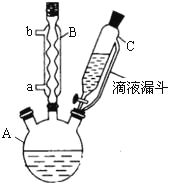
【题目】(14 分)对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应、装置图如下:
![]()
![]()
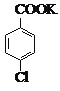 +MnO2
+MnO2 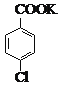
![]()
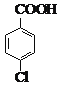
常温条件下的有关数据如下表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是 。
(2)量取6.00mL对氯甲苯应选用的仪器是 。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 。对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 。
(4)第一次过滤的目的是 ,滤液中加入稀硫酸酸化,可观察到的实验现象是 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 。
(6)本实验的产率是 (填标号)。A.60% B.70% C.80% D.90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
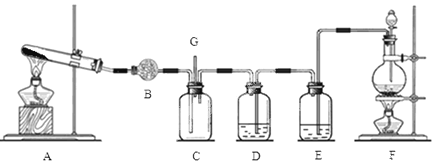
(1)装置F中发生反应的离子方程式是 ;
(2)装置B中盛放的是 ,其作用是 ;装置E中盛放的试剂是 ,其作用是 ;
(3)装置A中发生反应的化学方程式为: ;
(4)若有10.7gNH4Cl,最多可制取标准状况下的氨气的体积是 L;
(5)装置C中有白烟产生,试写出该反应的化学方程式
(6)G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】
X、Y、Z、R为前四周期原子序数依次增大的元素。X的单质与氢气可化合生成气体G.,其水溶液pH>7;Y的原子中最外层电子数是内层电子数的3倍;Z的单质是一种黄色晶体;R基态原子3d轨道的电子数是4s轨道电子数的3倍。
请回答下列问题:
(1)Z元素在周期表中的位置________________;其单质的晶体类型是________________;X和Y元素的第一电离能较小的是___________(填元素名称);
(2)在Y、 Z的简单氢化物中,Y的氢化物更易溶于乙醇,其原因是_____________;G在一定条件下可与CO2反应生成一种最常见的氮肥M,M中所含元素原子的杂化方式为_____________;
(3) R单质与Z单质化合的产物J中,R离子的核外电子排布式是_____________;己知J与足量强碱性的NaC1O溶液在一定条件下反应,生成一种具有强氧化性的R的含氧酸根,该反应的离子方程式为_____________;
(4) G分子的立体构型为_______;R可形成化合物R(CO)5,该化合物中所含化学键的类型为_______;
(5) X与硼元素形成的化合物BX,其晶胞结构如图所示,该晶胞中含有的X原子数目为_____________;若最近的X、B原子之间的距离为anm,NA代表阿伏加德罗常数,则该晶体的密度为_____________g/cm
3(列式表示,不必化简)。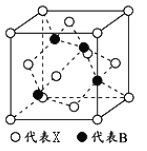
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1mol化学键时所需吸收的能量。下表是部分化学键的键能数据
化学键 | P—P | P—O | O=O | P=O |
键能 kJ·mol-1 | 197 | 360 | 499 | X |
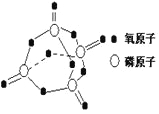
己知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0kJ ,且白磷分子结构为正四面体,4 个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如上图所示,则上表中X为
A.434 B.335 C.237 D.188
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com