
��14�֣�
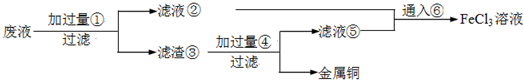
ijʵ��С���ù�ҵ�Ϸ������壨��Ҫ�ɷ�Cu2S��Fe2O3���������ȡ��ͭ��Fe2(SO4)3���壬��ƵIJ����������£�
��1�����ƾ��ƺ�����̨�����ż��⣬��������������ͼг������ֱ�Ϊ ��
���ٺ͢��ж��õ�������Ϊ ��
��2���Լ�x�Ļ�ѧʽΪ ��x����ҺB��Ӧ�����ӷ���ʽΪ ��
��3��ijͬѧȡ��������ҺB�����м��������ij��ǿ���������ٵμ�KSCN��Һ��������Һ���ɫ������һ��ʱ�����Һ��ɫ����ͬѧ�²���Һ��ɫ��ԭ������Һ�е�SCN�� ���������������������¡�
�ָ��������Լ���1.0 mol��L��1 ���ᡢ1.0 mol��L��1NaOH��Һ��0.1 mol��L��1Fe2(SO4)3��Һ��20%KSCN��Һ������ˮ��������ƺ���ʵ����֤��ͬѧ�IJ²��Ƿ��������Ҫ˵��ʵ�鲽������� ��
��4��ijͬѧ��ʵ���Ƶõ�Fe2(SO4)3��������0.1 mol��L��1 ��Fe2(SO4)3��Һ���ڳ�����Fe2(SO4)3������ܽ�þ���ľ������Ϊ ��
��1������������ǯ��2�֣�����������2�֣�
��2��H2O2��2Fe2+ + H2O2+ 2H+ = 2Fe3+ + 2H2O��ÿ��2�֣�
��3��ȡ������ɫ�����Һ���Թ��У�1�֣�����μ��������20%KSCN��Һ��1�֣�������Һ���ɫ��1�֣���˵����ͬѧ�IJ²��Ǻ����ģ��粻���ɫ��˵���²ⲻ����������μӹ�����0.1 mol��L��1Fe2(SO4)3��Һ������Һ�����ɫ��˵�������������ɫ��˵���²ⲻ������
��4���������ľ��������ձ��У�1�֣�������������ϡ���ᣨ1�֣�������ˮ���ò��������裨1�֣�
����:��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��һ�� | �ڶ��� | ������ | |
| ��Ʒ������/g | 6.830 | 13.660 | 30.000 |
| ����������������/L | 0.672 | 1.344 | 2.688 |
| �������/g | 0.800 | 1.600 | 3.200 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
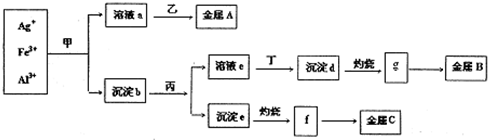
| A������A��B��C�ֱ�ΪAg��Fe��Al | B��g��f��Ϊ�������ҵ�Ͼ����õ��g��f��ö�Ӧ�������� | C������bΪ������Ҫ�ɷ�Ϊ����d�ͳ���e | D�������������ƣ���Ϊϡ���� |
�鿴�𰸺ͽ���>>
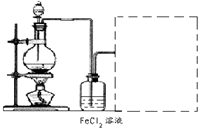
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �̷���FeSO4?7H2O������Ҫ�Ļ�ѧ�����Լ�����ҵ�ϳ����û�е�ӹ���ҵ�����ķ���мΪԭ���Ʊ���
�̷���FeSO4?7H2O������Ҫ�Ļ�ѧ�����Լ�����ҵ�ϳ����û�е�ӹ���ҵ�����ķ���мΪԭ���Ʊ���| ��� | ��Ӧ������ | ��Ʒ���� |
| 1 | n��H2SO4����n��Fe����1��1 | ���ڢ���֮�� |
| 2 | n��H2SO4����n��Fe����1��1 | ���ڢ� |
�鿴�𰸺ͽ���>>
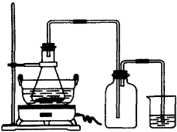
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�걱���к����������ڶ�ѧ����Ӧ����ϰ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��������������ˮ��ɱ��������
��1����ҵ�������缫��ʯī��Ϊ�缫��ⱥ��ʳ��ˮ�������������缫�� ����ʯī�缫�ϵĵ缫��ӦʽΪ ��
��2�������������ڼ��������£���Cl2����ˮ�е�CN-����������N2��CO2���÷�Ӧ�����ӷ���ʽΪ ��
��3���Ȱ���NH2Cl��������������Һ�ȴ�������ˮ��ͬʱͨ������������������Ӧ��Cl2 + NH3 = NH2Cl + HCl�����ɵ�NH2Cl��HClO�ȶ������ܲ���ˮ����������HClO��������ɱ�������á�
���Ȱ�������ɱ����ԭ���� ���û�ѧ�����ʾ����
���Ȱ��������������ˮ�У���Ԫ�ض���NH4+����ʽ���ڡ�
��֪��NH4+(aq) + 1��5O2(g)= NO2-(aq) + 2H+(aq) + H2O (l) ��H=��273 kJ��mol-1
NH4+(aq) + 2O2(g)= NO3-(aq) + 2H+(aq) + H2O (l) ��H =��346 kJ��mol-1
NO2-(aq)��O2������NO3-(aq)���Ȼ�ѧ����ʽΪ ��
��4����ˮ����ֳ�У�������Na2S2O3��ˮ�в������Cl2��ȥ��ijʵ��С��������ͼ��ʾװ�ú�ҩƷ�Ʊ�Na2S2O3��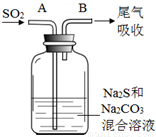
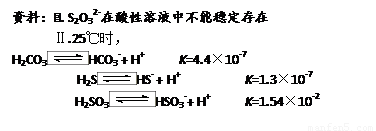
����������ϻش�
��ʼͨSO2ʱ����B�ڼ����µ��������ɣ��жϴ�B���ų����������Ƿ���H2S����д���ж����� ��
Ϊ��ý϶��Na2S2O3������Һ��pH�ӽ�7ʱ��Ӧ����ֹͣͨ��SO2����ԭ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com