
����Ŀ�������£��÷�̪��ָʾ������0.10mol��L��1NaOH��Һ�ֱ�ζ�20.00mLŨ�Ⱦ�Ϊ0.10mol��L��1�� CH3COOH��Һ��HCN��Һ���õζ�������ͼ��
����֪��CH3COOH�� HCN�ĵ���ƽ�ⳣ���ֱ�Ϊ1.75��10-5��6.4��10-10��

��1��ͼ__��a��b����NaOH��Һ�ζ�HCN��Һ��pH�仯�����ߣ��жϵ�������__��
��2�������ʾ��Һ����������Ũ�ȵĴӴ�С��˳��__��
��3����ٺ͵�� ��ʾ��Һ�У�c(CH3COO��)��c(CN��)__c(HCN)��c(CH3COOH)������>��<��=����
��4����ڢۢ���ʾ����Һ��ˮ�ĵ���̶��ɴ�С��˳���ǣ�__��
���𰸡�a HCN�ĵ���ƽ�ⳣ��С��ͬŨ�ȣ���������������Ũ��С��pHֵ�� c(CH3COO��)=c(Na+)>c(OH��)=c(H+) = �ܢۢ�
��������
��1������ƽ�ⳣ��ԽС����Խ����ͬŨ��pHֵԽ��
��2��bΪ���ᣬ���жϵ����ʾ��Һ�е����ʳɷ֣�������Һ�еĵ���غ������
��3�����ж����ʳɷ֣����ݸ���Һ�е������غ������
��4����ĵ�������ˮ�ĵ��룬�ε�ˮ��ٽ�ˮ�ĵ��룻
��1��������Ŀ������Ϣ��֪����ƽ�ⳣ��Ka(CH3COOH)> Ka(HCN)������ͬŨ�ȵ�CH3COOH��HCN��HCN�����Ը�ǿ��pHֵ��������aΪHCN��bΪCH3COOH���ʴ�Ϊ��a��HCN�ĵ���ƽ�ⳣ��С��ͬŨ�ȣ���������������Ũ��С��pHֵ��
��2������b�������ᣬ���ݼ����������Ƶ�����֪�����ʾ��Һ������ΪCH3COOH��CH3COONa�����ݵ���غ��֪��c(CH3COO��)+ c(OH��)= c(Na+) +c(H+)����ʱ��Һ�����ԣ�����c(OH��)=c(H+)������c(CH3COO��)=c(Na+)���ʴ�Ϊ��c(CH3COO��)=c(Na+)>c(OH��)=c(H+)��
��3�������ʾ��Һ������ΪCH3COOH��CH3COONa�������ʵ���֮��Ϊ1:1�����������غ��֪c(CH3COOH)+ c(CH3COO��)=2c(Na+)��ͬ����֪�����ʾ��Һ�У�c(HCN)+ c(CN��)=2 c(Na+)������Һ�����������Ƶ�����ͬ������������Ũ����ͬ����c(CH3COOH)+ c(CH3COO��)= c(HCN)+ c(CN��)������c(CH3COO��)��c(CN��)=c(HCN)��c(CH3COOH)��
��4�������ʾ��Һ������ΪCH3COOH��CH3COONa�������ʵ���֮��Ϊ1:1������ĵ���̶ȴ���ˮ��̶ȣ���ʱˮ�ĵ����ܵ����ƣ������ʾ��Һ������ΪCH3COOH��CH3COONa����ʱ��Һ�����ԣ���Һ��c(OH-)=10-7mol/L����ȫ����ˮ���룬��ĵ�����ε�ˮ���������ˮ�ĵ���Ȳ��ܵ�����Ҳ���ܵ��ٽ��������ʾ��Һ������ΪCH3COONa��ֻ���ε�ˮ��ٽ�ˮ�ĵ��룬����ˮ�ĵ���̶ȴӴ�С����Ϊ�ܢۢڣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��֪ʶ��������������Чѧϰ�ķ���֮һ��ijѧϰС�齫�й�����ⱥ��ʳ��ˮ����������ݽ����������γ���������(��ʾ�ĵ缫��Ϊʯī)��
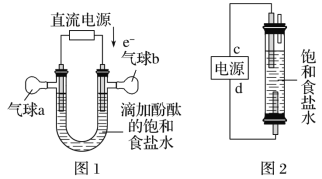
��1��ͼ1�У����һ��ʱ�������b�е�������___(�ѧʽ)��
��2������ͼ2����һ�ֻ���������Һ�������������Ʊ���84������Һ����Ч�ɷ�NaClO����cΪ��Դ��__�����÷������з�Ӧ�������ӷ���ʽΪ__��
��3����������(ClO2)Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ������������ͼ��Ŀǰ�ѿ������õ�ⷨ��ȡClO2���¹��ա�
����������ClO2�ĵ缫��Ӧʽ��__��
�ڵ�����������״����112mL����ʱ��ͨ�������ӽ���Ĥ���ӵ����ʵ���Ϊ___��
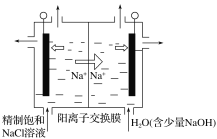
��4��װ��2�����Ϊ�Ȼ�����Һ���ҳ�Ϊ����ͭ��Һ��һ��ʱ����ҳ���Һ��c��Cu2+��__(����������������С������������)������װ�õ�������ʢװ����NH4NO3����֬��Һ���������е�__���ӣ�����NH4+������NO3���������Ȼ�����ҺǨ�ơ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С����ʵ����̽����������泥�NH2COONH4���ֽⷴӦƽ�ⳣ����ˮ�ⷴӦ���ʵIJⶨ��
��1����һ���������İ���������������Ƶ��ܱ���������У���������������䣬��������������Բ��ƣ����ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4��s��2NH3��g��+CO2��g����ʵ���ò�ͬ�¶��µ�ƽ�����������±���
�¶ȣ��棩 | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
ƽ����ѹǿ��kPa�� | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
ƽ��������Ũ�ȣ���10��3mol/L�� | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
�ٿ����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ�����___������ĸ����
A��2v��NH3��=v��CO2�� B���ܱ���������ѹǿ����
C���ܱ������л��������ܶȲ��� D���ܱ������а����������������
�ڸ��ݱ������ݣ�����25.0��ʱ�ķֽ�ƽ�ⳣ��Ϊ___________ ��
��2����֪��NH2COONH4+2H2O![]() NH4HCO3+NH3H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c��NH2COO������ʱ��仯������ͼ��ʾ��
NH4HCO3+NH3H2O�����о�С��ֱ������ݲ�ͬ��ʼŨ�ȵİ����������Һ�ⶨˮ�ⷴӦ���ʣ��õ�c��NH2COO������ʱ��仯������ͼ��ʾ��
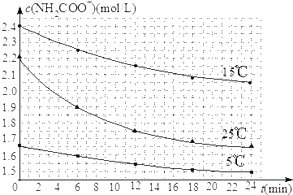
�ۼ���25��ʱ��0��6min���������ˮ�ⷴӦ��ƽ������Ϊ__________ ��
�ܸ���ͼ����Ϣ�����˵��ˮ�ⷴӦ��ƽ���������¶����߶�����________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£��ܱ������з�����ӦMg)N(g)����Ӧ�����е������仯��ͼ��������ʾ,����˵���������

A.�÷�Ӧ����Ӧ���ΪE3-E2
B.�÷�Ӧ����H=E1-E2
C.���ߢ��ʾ�����������䣬�����¶�ʱ�������仯
D.���ߢ��ʾ�����������䣬�������ʱ�������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����������������ȷ���ǣ� ��
A.һ���¶Ⱥ�ѹǿ�£�������̬��������Ĵ�С���ɹ�������ķ��Ӵ�С����
B.һ���¶Ⱥ�ѹǿ�£�������̬��������Ĵ�С���ɹ�������ķ���������
C.��ͬ�����壬�������ͬ�������������ķ�����Ҳ��ͬ
D.����Ħ�����ָ1mol�κ�������ռ�����ԼΪ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������������ȷ����( )
A.��״���£�22.4 LCCl4���еķ�����ΪNA
B.��״���£�aL�����͵����Ļ�����庬�еķ�����ԼΪ![]()
C.46g NO2��N2O4�Ļ�������к��е�ԭ����Ϊ6NA
D.56gFe�����������ᷴӦ��ת�Ƶĵ�����Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������Ӽ����˵������ȷ���ǣ� ��
A.��ij��Һ�м�ϡ���ᣬ����������ɫ��ζ����ͨ�����ʯ��ˮ�У�ʯ��ˮ����ǣ���ԭ��Һ��һ�����д���CO![]()
B.��ij��Һ�м��������ữ�����ᱵ��Һ���а�ɫ������������ԭ��Һ��һ����SO![]()
C.��ij��Һ�м���Ũ����������Һ�����ȣ�������������ʹʪ��ĺ�ɫʯ����ֽ��������ԭ��Һ�ʼ���
D.��ij��Һ�м�����������Һ������ɫ�������ټ�ϡ���ᣬ��������ʧ����ԭ��Һ��һ����Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ��β����Ҫ����![]() ��������
��������![]() ��
��![]() ��ʯ��β��ΪþԴ�Ʊ�̼��þ����
��ʯ��β��ΪþԴ�Ʊ�̼��þ����![]() �Ĺ������£�
�Ĺ������£�
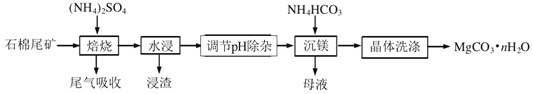
��֪�������������е�����ӦΪ��![]()
![]() д�����ղ���
д�����ղ���![]() �ĵ���ʽ______��
�ĵ���ʽ______��
![]() Ϊ���ˮ�����ʣ��ɲ�ȡ�Ĵ�ʩΪ______
Ϊ���ˮ�����ʣ��ɲ�ȡ�Ĵ�ʩΪ______![]() ��дһ��
��дһ��![]() ��������������Ҫ�ɷ�Ϊ____��
��������������Ҫ�ɷ�Ϊ____��
![]() ������pH������ʱ���轫pH����
������pH������ʱ���轫pH����![]() �����ȥ������������______����ʱ��Һ�е�
�����ȥ������������______����ʱ��Һ�е�![]() ______
______![]() ��֪
��֪![]() ��
��
![]() ����þ�������з�Ӧ�����ӷ���ʽΪ______��
����þ�������з�Ӧ�����ӷ���ʽΪ______��
����þ��ʱ���¶ȳ���![]() ���������϶�ļ�ʽ̼��þ���ʣ�ԭ����______
���������϶�ļ�ʽ̼��þ���ʣ�ԭ����______
![]() �����п���ѭ�����õ�������______
�����п���ѭ�����õ�������______![]() �ѧʽ
�ѧʽ![]() ��
��
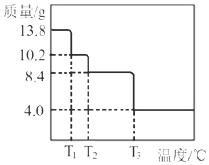
![]() ijС��ͬѧ��ȡ
ijС��ͬѧ��ȡ![]()
![]() �������ط�����������ʣ������������¶Ȼ���������ͼ��ʾ����
�������ط�����������ʣ������������¶Ȼ���������ͼ��ʾ����![]() ______��
______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը�����������Ҫ�ɷ�ΪAl2O3��Fe2O3��SiO2������FeS2�ͽ��������Σ�Ϊԭ�ϣ����������������Fe3O4�IJ��ֹ����������£�
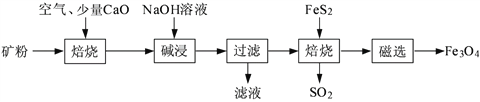
��1�����չ��̾������SO2����NaOH��Һ���չ���SO2�����ӷ���ʽΪ______________________��
��2������1%CaO�Ͳ�����CaO�Ŀ�۱��գ�����ȥ�������¶ȱ仯��������16ͼ��ʾ��
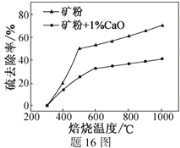
��֪���������������εķֽ��¶ȶ�����600 ��
��ȥ����=��1��![]() ����100%
����100%
�ٲ�����CaO�Ŀ���ڵ���500 �決��ʱ��ȥ������Ԫ����Ҫ��Դ��__________________��
��700�決��ʱ������1%CaO�Ŀ����ȥ���ʱȲ�����CaO�Ŀ����ȥ���ʵͣ�����Ҫԭ����______________________________________________________��
��3�������������õ�����Һ��ͨ�����CO2����Ԫ�ش��ڵ���ʽ��_______________���ѧʽ��ת��Ϊ_______________���ѧʽ����
��4�����������õ��������к�������Fe2O3��Fe2O3��FeS2��Ϻ���ȱ�������±�������Fe3O4��SO2����������ȫ��Ӧ���ĵ�n��FeS2����n��Fe2O3��=__________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com