
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、高锰酸钾酸性溶液 | B. | 碳酸钠溶液、溴水 | ||
| C. | 新制的银氨溶液溶液、溴水 | D. | 新制氢氧化铜悬浊液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 1.68 L | C. | 3.36 L | D. | 1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用. 请回答下列问题:
已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用. 请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车制造商:车的外形变得美观,能够提高销量;易于加工,降低成本 | |
| B. | 车主:车的重量减轻,油耗降低;汽车价格便宜 | |
| C. | 意外被保险杠撞到的行人:具有缓冲作用,减轻伤害 | |
| D. | 旁观者:用塑料作保险杠不安全 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
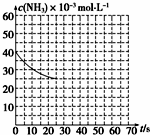 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 | 1.77×10-5 |
| Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.
其中氧化剂是MnO2,氧化产物是Cl2,氧化剂和还原剂物质的量之比是1:2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 在铁板表面涂抹油漆,不能防止铁板被腐蚀 | |
| C. | 钢铁在干燥空气中不易被腐蚀 | |
| D. | 用牺牲锌块的方法来保护船身 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com