
【题目】我国科研团队成功研究出高比能量、低成本的钠离子二次电池,其工作原理示意图如图。已知电池反应:Na1-xMnO2+NaxCn![]() NaMnO2+nC。下列说法正确的是( )
NaMnO2+nC。下列说法正确的是( )
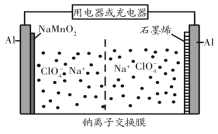
A.电池放电过程中,NaMnO2/Al上的电势低于石墨烯/Al上的电势
B.电池放电时,正极可发生反应Na1-xMnO2+xNa++xe-=NaMnO2
C.电池充电时,外接电源的负极连接NaMnO2/Al电极
D.电池充电时,Na+由NaMnO2/Al电极移向石墨烯/Al电极
【答案】BD
【解析】
放电过程总反应式为:Na1-xMnO2+NaxCn=nC+NaMnO2,可知C元素的化合价升高,Mn元素的化合价降低,则负极是石墨烯/Al,正极为NaMnO2/Al,则充电时石墨烯/Al发生还原反应为阴极,NaMnO2/Al发生氧化反应为阳极。
A.放电时NaMnO2/Al为正极,石墨烯/Al为负极,正极电势高于负极电势,故A错误;
B.放电时,正极得电子发生还原反应,根据总反应可知正极反应为Na1-xMnO2+xNa++xe-=NaMnO2,故B正确;
C.充电时NaMnO2/Al发生氧化反应为阳极,与外接电源的正极相连,故C错误;
D.充电时为电解池,电解池中阳离子流向阴极,即由NaMnO2/Al电极移向石墨烯/Al电极,故D正确;
故答案为BD。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
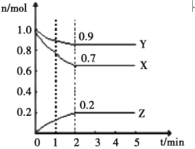
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某样品中氟元素的质量分数进行如下实验,利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(氢氟酸为低沸点酸,含量低,不考虑对玻璃仪器的腐蚀),用水蒸气蒸出,再通过滴定测量。实验装置如下图所示,加热装置省略。
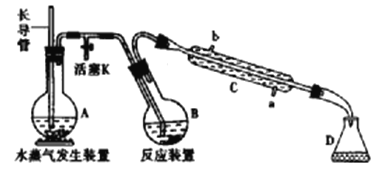
(1)A的名称是___________,长导管用于平衡压强,实验过程中其下端___________(填“能”或“不能”)在液面以上。
(2)仪器C是直形冷凝管,实验过程中,冷却水应从___________口出。(填“a”或“b")
(3)实验时,首先打开活塞K,待水沸腾时,关闭活塞K,开始蒸馏:若蒸馏时因反应装置局部堵塞造成长导管水位急剧上升,应立即______________________。
(4)连接水蒸气发生装置和反应装置之间的玻璃管常裹以石棉绳,其作用是___________。
(5)B中加入一定体积高氯酸和1.00g氟化稀土矿样,D中盛有滴加酚酞的NaOH溶液。加热A、B,使A中产生的水蒸气进入B。
①下列物质不可代替高氯酸的是___________(填标号)
a.醋酸 b.硝酸 c.磷酸 d.硫酸
②D中主要反应的离子方程式为_________________________________。
(6)向馏出液中加入25.00mL0.100mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用0.100 mol·L -1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1︰1络合),消耗EDTA标准溶液20.00mL,则氟化稀土样品中氟的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,应用这一反应,下列所给化合物中可以与钠合成环丁烷的是
A. CH2BrB. CH2BrCH2CH2CH2Br
C. CH2BrCH2CH2BrD. CH3CH2CH2CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钯是航天、航空高科技领域的重要材料。工业用粗钯制备高纯度钯的流程如图:
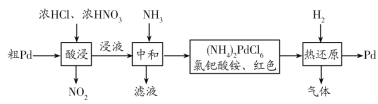
下列说法错误的是( )
A.酸浸时反应的化学方程式是Pd+6HC1+4HNO3=H2PdCl6+4NO2↑+4H2O
B.“热还原”中每生成1molPd同时生成的气体的物质的量为8mol
C.化学实验中可利用氯钯酸根离子检验溶液中是否含有NH4+
D.在“酸浸”过程中为加快反应速率可用浓硫酸代替浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL一定浓度的硝酸银溶液中,逐滴加入0.1mol·L-1的氨水,反应过程中-1gc(Ag+)或-1gc[Ag(NH3)2+]与加入氨水体积的关系如图。下列说法错误的是( )
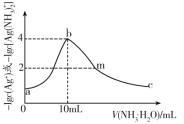
A.原硝酸银溶液的浓度是0.1mol·L-1
B.反应生成氢氧化银的Ksp(AgOH)的数量级为10-8
C.溶液b点NH4+的浓度小于溶液c点NH4+的浓度
D.溶液m点c(NO3-)>c(Ag+)+c[Ag(NH3)2+]+c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积固定的密闭容器中进行:N2(g)+3H2(g)![]() 2NH3(g),下列有关说法错误的是( )
2NH3(g),下列有关说法错误的是( )
A.达平衡时单位时间内生成氢气的物质的量与生成氨气的物质的量相同
B.使用催化剂可以加快反应速率,缩短达平衡时间
C.为了提高氢气的转化率,可以适当补充氮气
D.达平衡时,密闭容器中的气体的总物质的量比起始时的总物质的量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用酸性蚀刻废液(含![]() 等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
等)和碱性蚀刻废液[NH4+、Cu(NH3)42+ 、NH3·H2O等]制备CuI(白色固体)的实验流程如下:
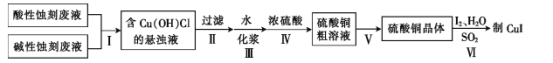
(1)步骤Ⅰ中发生了多个反应,其中![]() 与盐酸反应生成Cu(OH)Cl的离子方程式为____。
与盐酸反应生成Cu(OH)Cl的离子方程式为____。
(2)步骤Ⅳ需控制pH为1~2,80 ℃下进行,合适的加热方式是____。
(3)步骤Ⅴ的具体步骤是蒸发浓缩、______、____。
(4)步骤Ⅵ在下列装置(夹持及加热装置已省略)中进行。

①装置a中盛装浓硫酸的仪器的名称是___,圆底烧瓶中发生反应的化学方程式为___。
②装置c中反应完成的现象是_____。
③用装置d中的溶液洗涤制得的CuI的目的是____,然后再用无水乙醇洗涤的目的是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com