
| A. | 该溶液中,Ag+、K+、NO3?、Mg2+可以大量共存 | |
| B. | 该溶液中,H+、NH4+、SO42?、I?可以大量共存 | |
| C. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023 | |
| D. | 向该溶液中滴入少量Na2SO3溶液,反应的离子方程式为:SO32?+ClO?═Cl?+SO42? |
分析 A.可生成AgCl沉淀;
B.ClO?、I?发生氧化还原反应,且H+与ClO?反应;
C.发生ClO?+Cl?+2H+=Cl2+H2O,根据方程式计算;
D.SO32?、ClO?发生氧化还原反应.
解答 解:A.Ag+、Cl?可生成AgCl沉淀,不能大量共存,故A错误;
B.ClO?、I?发生氧化还原反应,且H+与ClO?反应,不能大量共存,故B错误;
C.发生ClO?+Cl?+2H+=Cl2+H2O,反应中Cl元素化合价分别由-1价、+1价 变为0价,则每产生1molCl2,转移电子约为6.02×1023,故C正确;
D.SO32?、ClO?发生氧化还原反应,离子方程式为SO32?+ClO?═Cl?+SO42?,故D正确.
故选CD.
点评 本题考查离子反应以及氧化还原反应,为高频考点,侧重考查学生的分析能力,注意把握常见离子的性质以及反应类型的判断,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 米饭、炒肉片、烧带鱼、炒青菜、水果 | |
| B. | 牛奶、炸鸡腿、面包、冰淇淋 | |
| C. | 红烧牛肉、凉拌黄瓜、冬瓜海带汤、烧豆腐 | |
| D. | 馒头、红烧牛肉、清蒸肉圆、骨头汤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
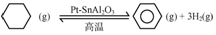
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是浓氨水,乙是浓硫酸 | B. | 甲是浓盐酸,乙是浓氨水 | ||
| C. | 甲是浓氨水,乙是浓盐酸 | D. | 甲是浓硝酸,乙是浓氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(B2)=0.9mol/(L•s) | B. | v(A2)=0.4mol/(L•s) | ||
| C. | v(B2)=90.0mol/(L•min) | D. | v(C)=36mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期ⅦA族p区 | B. | 第三周期ⅦB族p区 | C. | 第三周期ⅦA族s区 | D. | 第四周期ⅢB族s区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 0.1 mol•L-1稀硫酸中含有硫酸根个数为0.1NA | |
| B. | 常温下,1.12 L氮气所含原子数为0.1NA | |
| C. | 1 mol Na2O2与足量的盐酸反应,转移电子数为2NA | |
| D. | 常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①②③④ | C. | ①②④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com