
【题目】根据泡利的原子轨道能级图和“能级交错”现象,原子轨道的能量高低顺序是:
ns<(n-3)g<(n-2)f<(n-1)d<np(n为能层序数,g能级中有9个轨道)。则未来的第八周期应包括的元素的种类是
A. 128 B. 64 C. 50 D. 32
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,设计了如图1所示的实验装置(部分夹持装置未画出),来做乙醇催化氧化的实验,并验证其产物。请填写下列空白:


图1 图2
(1)在A处不断鼓入空气的情况下,熄灭B处的酒精灯,反应仍能继续进行,说明乙醇的催化氧化反应是_____________反应;(填“放热”或“吸热”)
(2)装置D使用冰水进行冷却的目的是___________________;
(3)反应开始一段时间,C中观察到的现象是____________________;
(4)为检测产物,取出试管a中部分液体,加入银氨溶液,水浴加热,可观察到E试管有银镜产生,说明乙醇的催化氧化产物中存在_____________;(填官能团名称)
(5)写出E处反应的化学方程式:_______________________________。
(6)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有________________。要除去该物质,可先在混合液中加入碳酸氢钠溶液,再通过________________(填实验操作名称)即可分离主要产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物的分离或提纯操作不正确的是( )
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去FeCl3溶液中Fe(OH)3沉淀可以过滤
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶不能用于提纯物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键
B.N-O键的极性比C-O键的极性小
C.氨易液化与氨分子间存在氢键有关
D.H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸广泛用于医药、食品、染料、化工等领域。以下是实验室制备苯甲酸的一种方法。反应原理:
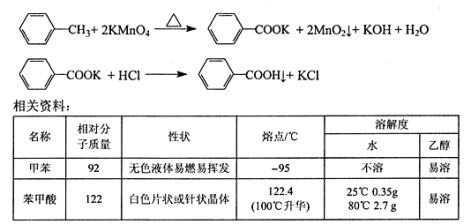

实验步骤:
①下图组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/ mL)。
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应。
③趁热过滤反应混合物。若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中。
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸。
回答下列问题:
(1)仪器 a名称为 。
(2)判断甲苯己完全反应的现象是 、回流液不再出现油珠。
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是 ;苯甲酸粗产品除了可用重结晶法精制外,还可用 法。
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100 mL溶液,分别取25.00mL溶液,用0.1000 mo1·L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52 mL.V3= 23.80mL。
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是 。
②若用酚酞作指示剂,确定滴定终点的现象是 。
③产品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气电池放电时的工作原理如图所示。下列叙述正确的( )

A.放电时Li+由B极向A极移动
B.电池放电反应为4Li+O2 +2H2O===4LiOH
C.正极反应式为O2+4H++4e-===2H2O
D.电解液a可以为LiCl水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在澄清透明的强酸性溶液中能大量共存的是( )
A. NH4+、Fe3+、SO42-、NO3- B. K+、Na+、CO32-、NO3-
C. K+、NH4+、OH-、SO42- D. Na+、K+、AlO2-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组中的两对物质,都能用分液漏斗分离且有机物层由分液漏斗上口倒出的是( )
A.汽油和水、四氯化碳和水
B.汽油和水、食用油和水
C.食用油和水、醋酸和水
D.葡萄糖和水、酒精和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和联氨(N2H4)既是一种工业原料,又是一种重要的工业产品。
(1)实验室可用氯化铵与消石灰反应制取氨气,其反应的化学方程式为 。
(2)联氨在一定条件下可按下式分解:3N2H4(g)=N2(g)+4NH3(g),已知断裂1molN—H、N—N及N≡N需吸收的能量依次为390.8kJ、193kJ、946kJ。若生成1molN2,则反应 (填“放出”或“吸收”) kJ的能量。
(3)NH3—O2燃料电池的结构如图所示。

①a极为电池的 (填“正”或“负”)极。
②当生成1molN2时,电路中流过电子的物质的量为 。
(4)联氨可以高效地脱除烟道气中的NO从而生成N2,该反应中氧化产物与还原产物的物质的量之比为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com