
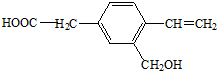
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A、分子式为C10H10O3,是一种芳香烃 |
| B、能发生加聚反应,也能发生酯化反应 |
| C、1 mol A能分别与1 mol金属钠、2mol NaOH反应 |
| D、A分子中所有原子可能在同一平面上 |


科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应Ca(OH) 2+2H+=Ca2++2H2O |
| B、氢氧化钡与硫酸铜溶液混合:Ba2++2OH-+Cu2++SO42-=BaSO4↓+Cu (OH) 2↓ |
| C、铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag |
| D、氯化铁溶液与氨水反应Fe3++3OH-=Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol | ||
B、
| ||
C、
| ||
| D、5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
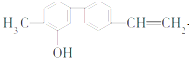
| A、一个分子中含有14个H原子 |
| B、苯环上一氯取代物有2种 |
| C、含有一种含氧官能团 |
| D、分子式是C15H14O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CS2为V形的极性分子 |
| B、电子云示意图中的每个小黑点都表示一个电子 |
| C、非极性键也可以存在于化合物中 |
| D、甲烷、氨和水都是由极性键结合而成的极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应时间/min | n(CO)/mol | H2O/mol | 放出的热量/kJ |
| 0 | 1.20 | 0.60 | 0 |
| t1 | 0.80 | Q | |
| t2 | 0.20 |
| CO | H2O | CO2 | H2 | |
| 起始浓度(mol/L) | 0.2 | 0.3 | 0 | 0 |
| 平衡浓度(mol/L) | a | b | c | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:
如图所示的实验装置中,X、Y分别为直流电源的两极.在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入多孔铂电极,切断电源开关S1,合闭开关S2,通直流电一段时间后,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com