
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| C. | 氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O | |
| D. | Ca(HCO3)2溶液中加入过量KOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
分析 A.氨水为弱碱,一水合氨不能拆开;
B.氯化钙与碳酸氢钾溶液不发生反应;
C.氢氧化铝与盐酸反应生成氯化铝和水;
D.氢氧化钾过量,反应生成碳酸钙沉淀、碳酸钾和水.
解答 解:A.向盐酸中滴加氨水,反应生成氯化铵和水,正确的离子方程式为:H++NH3•H2O═H2O+NH4+,故A错误;
B.氯化钙不与碳酸氢钾溶液反应,无法书写离子方程式,故B错误;
C.氢氧化铝与盐酸发生反应,从而可中和胃酸,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,故C正确;
D.Ca(HCO3)2溶液中加入过量KOH溶液反应生成碳酸钙沉淀、碳酸钾和水,正确的离子方程式为:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列离子反应方程式中,属于水解反应的是( )
A.NH4++H2O=NH3·H2O+H+
B.CO32-+H2O H2CO3-+2OH-
H2CO3-+2OH-
C.HCO3-+H2O=H++CO32-
D.CH3COO-+H2O CH3COOH+
CH3COOH+ OH-
OH-
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
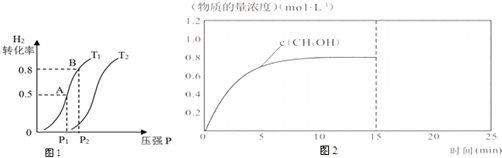
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止电池中的重金属污染土壤和水体,应积极开发废旧电池的综合回收利用 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 大量的汽车尾气是造成雾霾天气的一个重要因素 | |
| D. | 煤的液化和气化均属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内用O2表示的平均速率为1.48×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2 | |
| C. | T1温度下N2O5的平衡转化率为50% | |
| D. | 平衡后其它条件不变,将容器的体积压缩到原来的一半,则再平衡时c(N2O5)>5.00mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
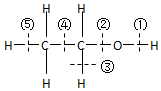
| A. | 和金属钠反应是键①断裂 | B. | 和浓硫酸共热到170℃时断键②和⑤ | ||
| C. | 和浓硫酸共热到140℃时仅断键② | D. | 和浓氢溴酸混合加热时断键② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 用小苏打 (NaHCO3)治疗胃酸过多:HCO3-+H+═H2O+CO2↑ | |
| C. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com