
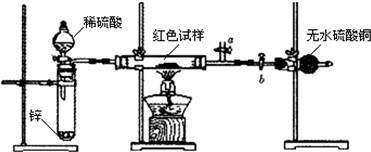
 已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
已知:①Cu2O与Cu均为红色固体,Cu2O酸性条件下易发生歧化反应.
| ||
| ||
| 128 |
| 144 |
| b-a |
| c-a |
| 9b-a |
| 8 |
| 9b-a |
| 8 |
| ||
| ||
| 9b-a |
| 8 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1个 | B、2个 | C、3个 | D、4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在淀粉溶液中加稀硫酸充分反应后,再加入银氨溶液,可检验淀粉的水解产物 |
| B、用溴水可以鉴别苯、乙醇、四氯化碳三种液体 |
| C、除去苯中的苯酚,可加入NaOH溶液后再分液 |
| D、将氯乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明氯乙烷发生了消去反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:
FeCl3在铜版印刷中用作印刷电路铜板腐蚀剂,按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、HCO3-、Cl- |
| B、Fe3+、NO3-、Cl-、SO42- |
| C、Na+、H+、SO32-、NO3- |
| D、SiO32-、Na+、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 装置 | C | D |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com