
| A. | 0.1mol | B. | 0.05mol | C. | 0.15mol | D. | 0.11mol |
分析 1.92gCu的物质的量为:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,与硝酸反应生成Cu(NO3)2、NO和NO2,根据n=$\frac{V}{{V}_{m}}$计算出生成气体的物质的量,然后根据N元素守恒计算反应中消耗HNO3的物质的量.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,Cu与硝酸反应生成Cu(NO3)2、NO和NO2,
根据原子守恒生成硝酸铜的物质的量为:n(HNO3)=2n[Cu(NO3)2]=2n(Cu)=2×0.03mol=0.06mol,
生成的气体为氮的氧化物,其物质的量为:n(NO)+n(NO2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
根据N元素守恒可知共消耗硝酸的物质的量为:0.06mol+0.05mol=0.11mol,
故选D.
点评 本题考查化学方程式的计算,题目难度中等,注意浓硝酸和稀硝酸的性质的不同,从质量守恒的角度解答该题,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -10+3n | B. | -6+3n | C. | -(12-3n) | D. | -(4-2n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2的消耗速率等于NO的消耗速率 | |
| B. | 容器内始终有N2、O2和NO共存 | |
| C. | 容器内反应混合物的总物质的量不随时间改变 | |
| D. | V正(N2)=V逆(N2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于5 s | B. | 大于5 s | C. | 等于10 s | D. | 小于5 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锂(Li)与水反应比钠与水反应剧烈 | |
| B. | 砹(At)为有色固体,HAt极不稳定 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | HBrO4的酸性比HIO4的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| B. | 1L0.1 mol/L的NH4NO3溶液中氮原子数小于0.2NA | |
| C. | 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH- | |
| D. | 含0.1 mol FeCl3的溶液完全水解后得到的胶体粒子个数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
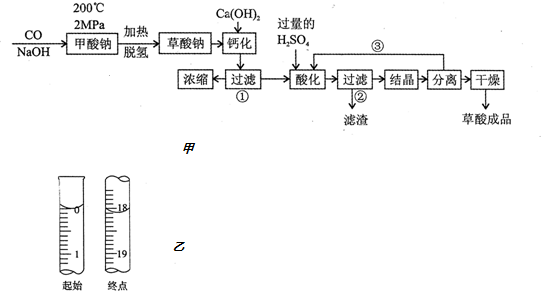
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com